
باتریهای لیتیوم یونی (تلفظ صحیح لیتیوم-آیون است اما یون رایج شده است) یا Lithium-Ion Battery که به اختصار LIB هم گفته میشود، یکی از انواع باتری هستند که ساختار خاص خود را دارند ولیکن اصول کلی یک باتری را در این نوع خاص هم شاهد هستیم مثل استفاده از مادهی الکترولیت که قرار است یونها را بین دو قطب مثبت یا کاتد و منفی یا آند جابجا کند. مثلاً در نمونهی زیر دو الکترود و الکترودی از جنس نمک برای ذخیره کردن انرژی به کار رفته است:
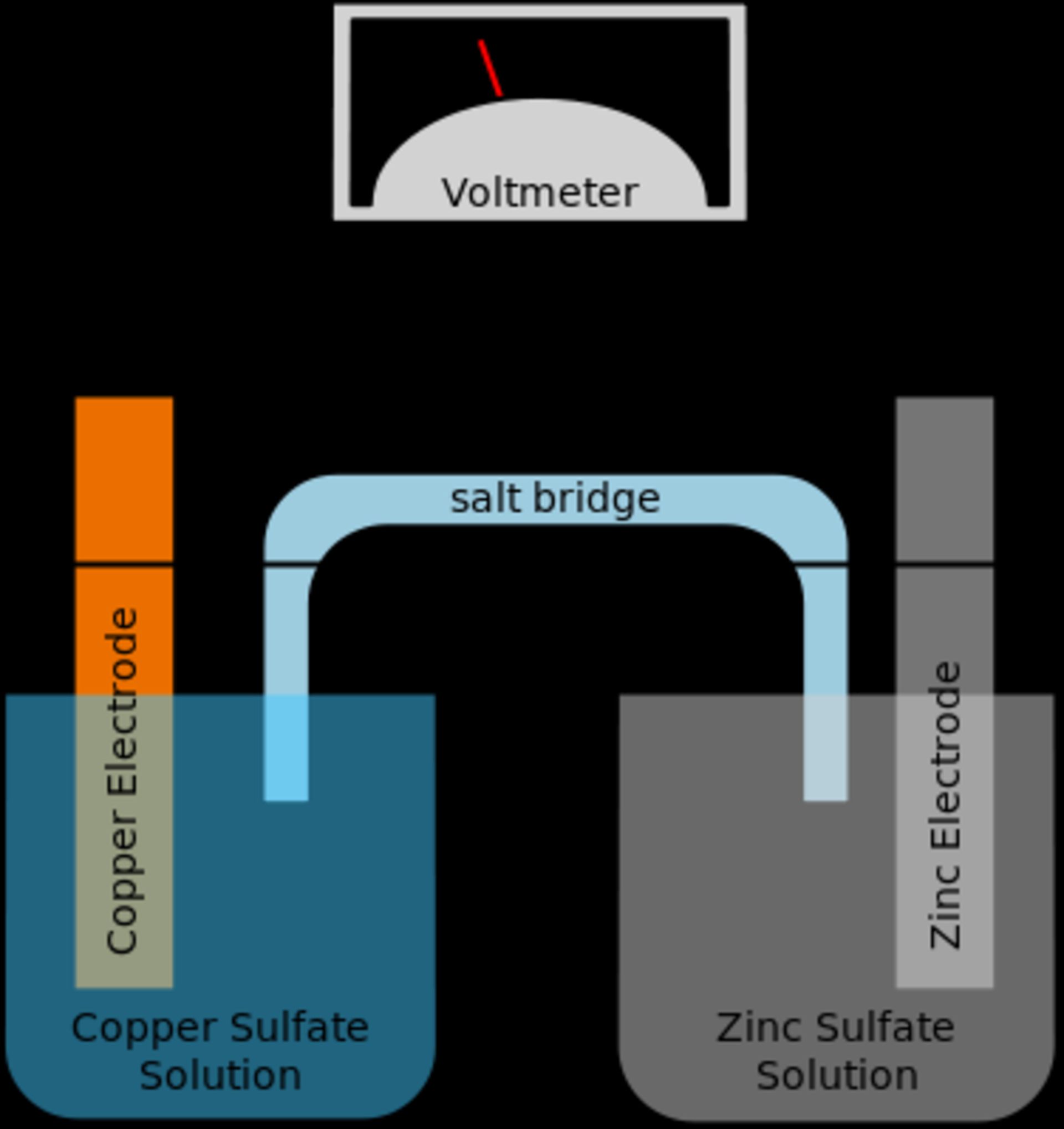
شارژ و دشارژ با حرکت یون لیتیوم ممکن میشود
در باتری لیتیوم یون، همانطور که نام باتری گویای آن است، این یونهای لیتیوم هستند که با جابجایی خود در الکترولیت، عمل شارژدهی یا شارژ شدن را ممکن میکنند. سر مثبت باتری از جنس آلومینیوم است و سر منفی از مس تشکیل میشود. وقتی باتری کاملاً دشارژ شده باشد، تمام یونهای لیتیوم در اطراف الکترود مثبت یا کاتد جمع شدهاند.
هنگام دشارژ یا شارژدهی باتری، لیتیوم الکترون خود را به آند واگذار میکند و خودش به عنوان یون مثبت، به کاتد میپیوندد
همانطور که میدانید، لیتیوم از فلزات گروه یک جدول تناوبی است که به شدت با نافلزات واکنش میدهد. اگر طبق تئوری کلاسیک صبحت کنیم، یک الکترون لایهی آخر خود را در اختیار نافلزات قرار میدهد تا پیوندی یونی شکل بگیرد. در محیط الکترولیت هم اگر بازهی دشارژ را در نظر بگیریم، لیتیوم الکترون خود را به قطب منفی یا آند واگذار کرده و تبدیل به یونی با بار مثبت میشود. در ادامه بدون یک الکترون خود سراغ الکترود مثبت میرود. به عبارت سادهتر، خاصیت شیمیایی لیتیوم آن را به سمت قطب مثبت میکشاند.
اما در هنگام شارژ اوضاع کاملاً برعکس میشود. به این معنی که الکترونها از قطب منفی وارد الکترولیت شده و به یونهای لیتیوم میپیوندند. لیتیومها که حالا خنثی شدهاند، دوباره به سمت قطب منفی کوچ میکنند تا مجدداً آمادهی تحویل الکترون و به عبارتی شارژدهی شوند.
جنس الکترود در باتری لیتیوم یون، متنوع است
معمولترین مادهای که به عنوان الکترود منفی ایفای نقش میکند، گرافیت است. ساختار صفحهای اتمهای کربن که آرایش شش ضلعی دارند و هادی الکتریسیته هستند. قطب مثبت یا کاتد هم معمولاً سه نوع دارد. اکسید لیتیوم کبالت یا اکسیدهای مشابه به صورت لایهای، پلیالکترولیتهایی مثل فسفات لیتیوم آهن و اسپینلهایی مثل اکسید لیتیوم منیزیم. تصویر زیر گویای همه چیز است. فرآیند شارژ به صورت خلاصه این است که یون لیتیوم با دریافت الکترون از آند، در کنار لایههای گرافیتی جا خوش کند.در هنگام دشارژ هم یک الکترون خود را مجدداً به لایههای گرافیکی قطب منفی واگذار کرده و اکسید لیتیوم کبالت شکل بگیرد. کبالت هم در این فرآیند، از حالت 4 بار مثبت به 3 بار مثبت تغییر میکند تا لیتیوم یک بار مثبت را کنار خود جای دهد:
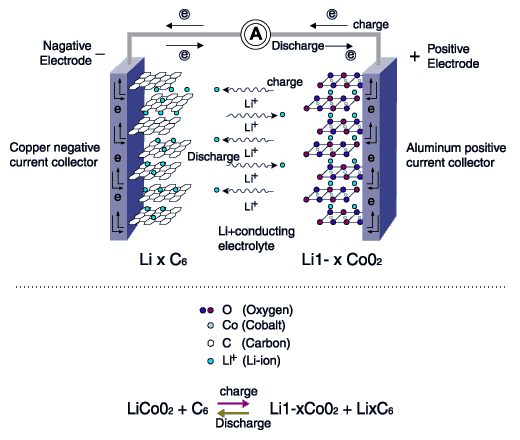
فرض کنید باتری کاملاً شارژ شده است. در این لحظه درون باتری مجموعهای از اتمهای لیتیوم را میبینیم که کنار قطب منفی قرار دارند و آمادهی واگذاری الکترون. در ابتدای فرآیند دشارژ با توجه به زیاد بودن اتمهای لیتیوم، ولتاژ بالاتر است و جریان به راحتی تأمین میشود. البته برای شروع دشارژ باید قطب مثبت و منفی باتری لیتیوم-یونی ما به هم پیوند بخورد. مستقیم یا غیر مستقیم، فرقی نمیکند، مهم این است که الکترولیت بخشی از چرخه را تشکیل داده تا الکترونها مسافرت خود را شروع کنند و بخش دیگر، اتصال قطب مثبت و منفی باتری در محیط بیرون است.
به ویدیویی در مورد نحوهی کار این باتریها توجه کنید:
علت کاهش ظرفیت و انفجار باتری چیست؟
باتریهای لیتیوم یونی هم مثل دیگر انواع باتری به مرور زمان ظرفیت مفید خود را از دست میدهند. قبلاً در بررسی باتریهای لیتیوم یونی و نحوهی شارژ صحیح به این نتیجه رسیدیم که دمای کارکرد پایینتر و پرهیز از شارژ کامل و خالی شدن کامل، به افزایش عمر باتری کمک میکند ولیکن همیشه ظرفیت باتری در حال کاهش است. مشکل اینجاست که در گذر زمان، در اطراف کاتد واکنش ایدهآلی که انتظارش را داریم رخ نمیدهد. واکنش برگشتناپذیر و به خصوص استفادهی ناصحیح عاملی است که کاتد را فرسوده میکند. البته باتریها به مدار کنترل دشارژ تجهیز میشوند تا از دشارژ عمیق جلوگیری شود.
اما علت انفجار چیست؟ پدیدهای که کمتر اتفاق میافتد اما به هر حال مهم و خطرناک است. فرض کنید گوشی در دست کاربر و کنار گوش او باشد، آتش گرفتن ناگهانی بسیار خطرناک است. نکته این است که لیتیوم از عناصر فعال گروه یک جدول تناوبی عنصرهاست. شاید دیده باشید که دو هم گروه لیتیوم یعنی سدیم و پتاسیم، وقتی روی سطح آب میافتند، چه واکنش شدیدی نشان میدهند، کار به آتش گرفتن و پرتاب شدن تکههای پتاسیم به بیرون ظرف هم میکشد! دقیقاً به همین علت است که الکترولیت باتریهای لیتیوم یونی باید عاری از آب باشد. الکترولیت معمولاً محلول یکی از نمکهای لیتیوم در حلالی آلی است.

مشکل از جایی شروع میشود که غشای بسیار باریکی که در ویدیوی فوق از آن صحبت شد، در حد بسیار کمی آسیب دیده است.
فرسایش کاتد عامل کاهش ظرفیت باتری است و آسیب دیدن غشای باریک درون الکترولیت، عامل آتش گرفتگی و انفجار
غشا برای جدا کردن دو بخش باتری به کار رفته لذا یک آسیب هر چند کوچک، باعث میشود که درون باتری پدیدهی اتصال کوتاه اتفاق بیافتد. شاید اتصال کوتاه سیمهای برق منزل را دیده باشید، جرقه و گرمای زیاد محصول آن است. اما در باتری لیتیوم یونی، تولید گرمای زیاد در داخل باتری، پایان کار نیست، گرمای تولید شده مسبب واکنشهای بعدی که گرمازا هستند میشود و در یک زمان نسبتاً کوتاه، متوجه میشوید که باتری آتش گرفته و حتی منفجر میشود.
در عمل به محض اینکه متوجه بلند شدن دود شدید، گوشی، لپتاپ یا باتری ربات خود را سریعاً به گوشهای پرتاب کنید چرا که نمیتوان جلوی آتش گرفتن آن را گرفت. از تجربهی شخصی خودم برایتان بگویم، جدا کردن شارژر از باتری در حال شارژ، دردی دوا نمیکند! باتری سریعاً و در عرض چند ثانیه به مرحلهی آتش گرفتگی میرسد! البته اگر زود متوجه دود آن شده باشید، شاید بتوانید گوشی و لپتاپ خود را از مرگ نجات دهید.
پیشگیری بهتر از درمان است، لذا اگر متوجه برآمدگی بیش از حد باتری شدید، بهتر است گوشی و لپتاپ خود را به خطر نیاندازید و باتری را تعویض نمایید
دشارژ بسیار خوب باتریهای لیتیوم یون
اگر قطب مثبت را با یک سیم نازک به قطب منفی متصل کنید، سریعاً سیم ذوب میشود! علت جریان بسیار بالایی است که از آن عبور میکند. نرخ دشارژ باتریهای لیتیوم پلیمری به صورت 1C یا 2C بیان میشود. هر چه عدد مربوطه بالاتر باشد، سرعت دشارژ هم بیشتر است.
به عنوان مثال فرض کنید شما هم به ساختن یک کوآدکاپتر نسبتاً سنگین علاقهمند شدهاید. باتریهای قلمی احتمالاً جوابگوی مسأله نیستند چرا که جریان الکتریکی کمی فراهم میکنند. به اصطلاح آمپر کمی دارند.

تعریف دقیق C-rate یا نرخ دشارژ 1C این است که یک باتری با جریانی برابر با ظرفیت خود به مدت 1 ساعت دشارژ میشود. مثلاً یک باتری 1000 میلیآمپر ساعتی در شرایط ایدهآل قادر است جریانی 1000 میلیآمپر را به مدت 1 ساعت تأمین کند. باتری 3000 میلیآمپر ساعتی یک گوشی یا تبلت هم اگر با نرخ دشارژ 2C دشارژ شود، قادر است جریان 6000 میلیآمپرساعتی را در مدت زمان 30 دقیقه فراهم آورد.
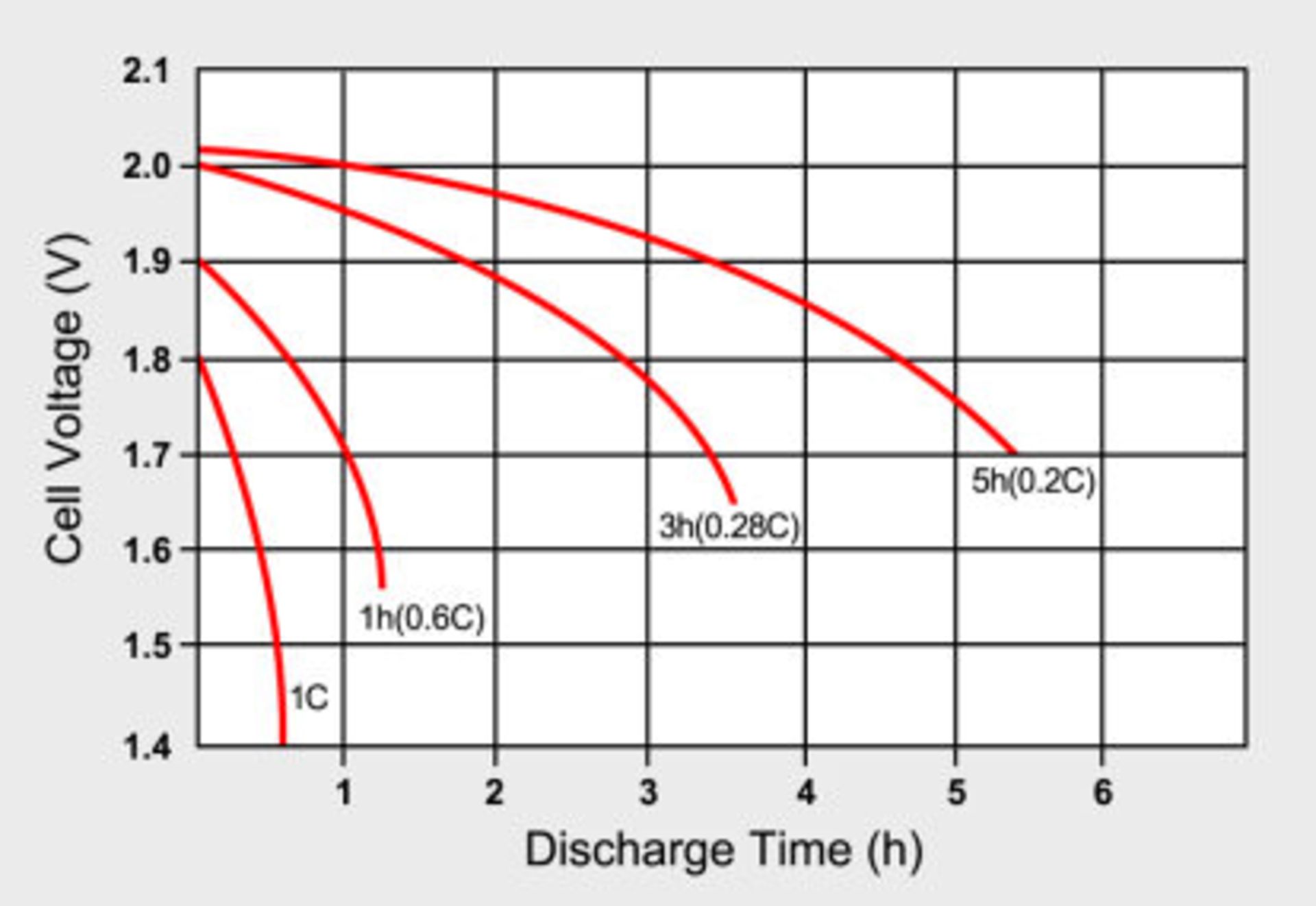
طبق معمول ولتاژ سلول هم با خالی شدن آن کاهش مییابد که در نمودار فوق مشاهده میکنید.
لیتیوم یون انرژی زیادی به نسبت وزن خود ذخیره میکند
باتریهای معمولی NiMH یا نیکل متال هیدرید، نرخ دشارژی بین 1.1 تا 2.8 ظرفیت خود دارند. بنابراین با در نظر گرفتن ولتاژ 1.2 ولتی خود، توانی معادل 8.4 وات( 2.8 در 2500 میلیآمپر در 1.2 ولت)، حداکثر چیزی است که از یک باتری شارژی نیکل متال هیدرید انتظار داریم. اما در مورد لیتیوم یون، یک سلول 2000 میلیآمپرساعتی که شاید وزن کمتری هم داشته باشد، توان مفیدی برابر با 14.4 وات را در اختیارمان قرار میدهد. با این توان، چرخاندن سریع روتورهای چهار موتور براشلس که روی کوآدکاپتر تعبیه شده، کار مشکلی نیست.
چرا باتری لیتیوم یون معروف و محبوب است؟
موضوع اصلی چگالی انرژی است که در محاسبات مذکور، تا حدی متوجه آن شدیم. منظور از چگالی انرژی این است که به ازای واحد وزن مثلاً یک گرم، چه قدر انرژی در باتری ذخیره میشود. 110 تا 160 واتساعت انرژی در یک کیلوگرم باتری لیتیوم-یونی ذخیره میشود که در مقایسه با دیگر انواع، یک رکورد است. لیتیوم-یون به ملاحظات نگهداری و مراقبت نیازی ندارد. در هر ماه تنها 10 درصد شارژ آن به خودی خود خالی میشود. بین 500 تا 1000 بار میتوان آن را پر و خالی کرد تا نهایتاً 20 درصد ظرفیت آن برایمان باقی بماند. با این خصوصیات یک گزینهی بهینه برای وسایل همراه و حتی دیگر ابزارها مثل پهپادها، رباتها و حتی خودروهای الکتریکی است.
| NiCd | NiMH | Lead Acid | Li-ion | Li-ion polymer | Reusable Alkaline |
|---|---|---|---|---|---|---|
چگالی انرژی وزنی (واتساعت بر کیلوگرم) | 45 تا 80 | 60 تا 120 | 30 تا 50 | 110 تا 160 | 100 تا 130 | 80 (حالت اولیه ) |
اتلاف داخلی انرژی (میلیوات) | 100 تا 2001 | 200 تا 3001 | کمتر از 100 | 150 تا 250 | 200 تا 300 | 200 تا 2000 |
ولتاژ نمونهی تست شده | 6 | 6 | 12 | 7.2 | 7.2 | 6 |
تعداد سیکل کارکرد تا رسیدن به ظرفیت 20 درصدی | 1500 | 300 تا 500 | 200 تا 300 | 500 تا 1000 | 300 تا 500 | (تا رسیدن به 50 درصد ظرفیت اولیه)50 |
کمترین زمان شارژ شدن | معمولاً 1 ساعت | 2 تا 4 ساعت | 8 تا 16 ساعت | 2 تا 4 ساعت | 2 تا 4 ساعت | 2 تا 3 ساعت |
خطای اورشارژ | متوسط | کم | زیاد | بسیار کم | کم | متوسط |
دشارژ خود به خودی در هر ماه در دمای اتاق (درصد) | 20 | 30 | 5 | 10 | حدود 10 | 0.3 |
ولتاژ نامی هر سلول (ولت) | 1.25 | 1.25 | 2 | 3.6 | 3.6 | 1.5 |
حداکثر نرخ دشارژ | 20C | 5C | 5C | >2C | >2C | 0.5C |
حداقل نرخ دشارژ | 1C | کمتر از 0.5C | 0.2C | کمتر از 1 C | کمتر از 1 C | کمتر از 0.2 C |
حداقل دمای کارکرد (سانتیگراد) | -40 | -20 | -20 | -20 | 0 | 0 |
حداکثر دمای کارکرد (سانتیگراد) | 60 | 60 | 60 | 60 | 60 | 60 |
ملاحظات نگهداری | 1 تا 2 ماه | 2 تا 3 ماه | 3 تا 6 ماه | لازم نیست | لازم نیست | لازم نیست |
هزینهی معمول یک باتری (دلار) | 50 | 60 | 25 | 100 | 100 | 5 |
ولتاژ معمول در تخمین هزینه | 7.2 | 7.2 | 6 | 7.2 | 7.2 | 9 |
هزینهی هر سیکل شارژ (دلار) | 0.04 | 0.12 | 0.1 | 0.14 | 0.29 | 0.1 تا 0.5 |
شروع استفادهی تجاری | 1950 | 1990 | 1970 | 1991 | 1999 | 1992 |
زمزمههای پیشرفت باتریهای لیتیوم-یونی
سالهاست که محققین روی باتریها مشغول به کار هستند تا تکنولوژیهای بهتری پیدا کنند. همانطور که مستحضر هستید، امروزه گوشیها و تبلتها از تمام جنبهها پیشرفت کردهاند و به نوعی یک کامپیوتر کوچک با امکانات اضافی مثل دوربین و جیپیاس و مودم مخابراتی هستند. یکی از بخشهایی که به نظر میرسد از قافلهی پیشرفت جا مانده، باتری است.
در کنار آزمایشات مختلف برای یافتن باتریهایی با ساختار الکتروشیمیایی جدید، باتریهای لیتیوم-یونی هم زیر میکروسکوپهای محققین قرار داشتهاند و کمی بهینه شدهاند. اما اخیراً نتایج خوبی از تحقیقات دانشگاه MIT روی باتریهایی که الکترود فسفات آهن لیتیوم دارند، به دست آمده است.
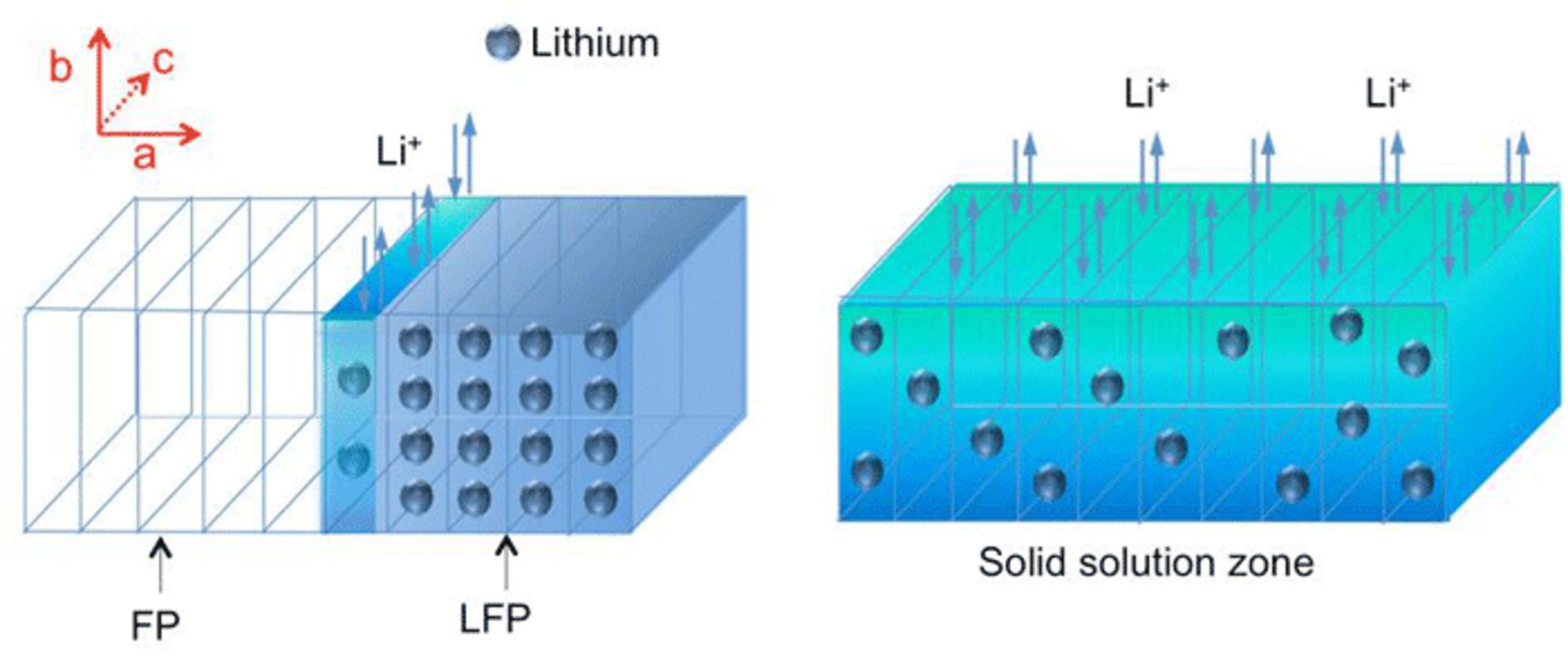
الکترود فسفات آهن یا FePO4 در ترکیب با یون لیتیوم به فسفات آهن لیتیوم تبدیل میشود که آمادهی شارژدهی است. محققین با بررسی دقیق به این نتیجه رسیدهاند که در فرآیند شارژ شدن باتری، مرزی بین بخش دشارژ شده یا FP که مخفف FePO4 است با LFP که مخفف LiFePO4 است شکل میگیرد. مرزی با ساختار نامنظم که در تصویر فوق مشاهده میکنید.
کشف SSZ بسیار مهم است چرا که عامل کلیدی در افزایش کارایی و عمر باتریهای لیتیوم یونی است
ناحیهی آبی روشن یا Solid Soulution Zone، نام مرز مورد بحث است. یونهای لیتیوم از این ناحیه جدا میشوند یا به آن اضافه میگردند. علت دوام بالای باتریهای مبتنی بر LFP هم وجود همین مرز باریک است. بنابراین روشن است که اگر SSZ گسترش یابد، نرخ شارژ و دشارژ و عمر باتری افزایش مییابد. از همه مهمتر، سطح شارژ و دشارژ یکنواخت خواهد شد و این به معنی ولتاژ نسبتاً ثابت است. در نتیجه نیازی به رگوله کردن یا به عبارت دیگر ثابت و یکنواختکردن ولتاژ باتری نیست. در حال حاضر باتری کاملاً پر ولتاژی بیش از 4 ولت دارد در حالیکه با خالی شدن باتری به 3.6 ولت افت پیدا میکند؛ بنابراین مدارات اضافی برای یکنواخت کردن آن نیاز است.
از مدتها پیش محققین میدانستند که به لحاظ تئوری ناحیهای به نام SSZ وجود دارد ولیکن این اولین بار است که صحنههای شارژ و دشارژ باتری را با روش خاصی که Akihiro Kushima و Li در سال 2010 معرفی کردهاند، شکار میکنند.
در ادامهی آزمایشات محققین از اضافه کردن ناخالصی یعنی پوشش کربنی استفاده کردند. نانوذرات کربن کاری میکنند که SSZ به شکل گستردهتر و پایدارتری شکل بگیرد و به فرآیند شارژ یا دشارژ کمک کند.
نظر شما در مورد باتریهای امروزی چیست و آیا فکر میکنید در آینده، با تحقیقاتی گستردهای که هر روزه انجام میشود، مشکل باتری به کلی حل خواهد شد یا اینها فقط سرابی از عمر یک هفتگی باتریهای نسل بعدی هستند؟