
بسیاری از افراد به اشتباه تصور میکنند که سرطان یک بیماری است در حالیکه سرطان نوعی از بیماری است که با تغییر در ساختار طبیعی یک سلول به وجود می آید. بدن انسان از متشکل از میلیونها سلول است که باعث ایجاد بافتهایی مانند ماهیچهها، استخوان و پوست میشود. سلولها بهطور منظم و کنترلشده تکثیر میشوند که این کار منجر به رشد و ترمیم بافتهای بدن میشود. اما رشد غیر عادی و بیش از حد سلولهای غیرطبیعی، تومور نامیده میشود که میتواند خوشخیم یا بدخیم باشد.
بهگفتهی سازمان بهداشت جهانی، حدود ۳۰ درصد تمام موارد سرطانها قابل پیشگیری هستند. برآورد شده است که تنها ۵ الی ۱۰ درصد تمام سرطانها به نقص ژن ارثی مربوط هستند و بقیهی سرطانها به آلایندههای زیستمحیطی، عفونتها و انتخاب شیوهی زندگی مانند، سیگار کشیدن، رژیم غذایی نامناسب و نداشتن فعالیت فیزیکی مربوط میشود. بزرگترین عامل خطر ایجاد سرطان در سطح جهان که قابل پیشگیری است سیگار کشیدن و استعمال تنباکو است. سلولهای سرطانی، سلولهایی غیرطبیعی هستند که به سرعت تولید مثل میکنند و تواناییشان را برای کپی شدن و رشد، حفظ میکنند. نتیجهی این رشد بدون کنترل سلول، ایجاد تودههای بافت یا تومور است.
تقریباً ۳۰ درصد سرطانها قابل پیشگیری هستند و بیش از ۱۰۰ نوع سرطان وجود دارد
تومورها همچنان به رشد ادامه میدهند و برخی که بهعنوان تومورهای بدخیم شناخته شدهاند، میتوانند از یک محل به محل دیگر منتشر شوند. سلولهای سرطانی از جنبههایی با سلولهای طبیعی متفاوت هستند. سلولهای سرطانی، پیری بیولوژیکی را تجربه نمیکنند، توانایی خود را برای تقسیم شدن حفظ میکنند، و به سیگنالهای پایان کار خود پاسخ نمیدهند. آنچه که ما بهعنوان سرطان میشناسیم در واقع گروهی بیش از ۱۰۰ مدل بیماری مختلف است. نقطهی مشترک تمامی این بیماریها، رشد بیرویه و غیرمعمول سلولهای بدن است. این رشد سبب از بین رفتن بافتهای اطراف میشود و حتی در حالتی وخیم، طی مرحلهی متاستاز، این سلولها به دیگر بخشهای بدن نیز سرایت میکنند و رشد را در آن ناحیه ادامه میدهند. در ادامه به انواع تومورهای سرطانی میپردازیم.
تومورهای خوشخیم
این دسته از تومورها آهسته رشد میکنند و به بافتهای دیگر تهاجم نمیکنند یعنی معمولا محدود به قسمت کوچکی از بدن هستند. بااینحال این دسته از تومورها عمر افراد را کوتاه نمیکنند با درمان به موقع قابل کنترل هستند که تنها راه درمان تومورهای خوشخیم جراحی است. البته دسته محدودی از تومورهای خوشخیم ممکن است کشنده باشند؛ در صورتی که در محلهای خاصی به وجود بیایند و اختلال در یک اندام حیاتی ایجاد کنند ممکن است منجر به مرگ فرد شوند. اما بااینحال اکثر تومورهای خوشخیم منجر به مرگ نمیشوند.
تومورهای بدخیم
اما در نقطه مقابل تومورهای خوشخیم، تومورهای بدخیم هستند چراکه این تومورها از ناحیه محدودی شروع به رشد میکنند اما به سرعت به بافتها و ارگانهای دیگر بدن تجاوز میکنند. بخشهایی که بهطور طبیعی عهدهدار دفاع از بدن هستند مانند سیستم ایمنی بدن ممکن است قادر به پیشگیری از تقسیم بیرویه نباشند. تومورهای سرطانی بدخیم ممکن است اتصال خود را با بافت تومورال از دست بدهند و ازطریق جریان خون یا توسط سیستم لنفاتیک به مناطق دورتری در بدن منتقل شوند و درآنجا رشد کنند و ارگان دیگری از بدن را به سرطان مبتلا کنند. این عمل متاستاز نام دارد و زمانی رخ میدهد که سرطان پیشرفت کرده باشد. یکی از ترسناکترین اتفاقات در مورد سرطان، پروسهی متاستاز است. طی این مرحله، میلیونها سلول مبتلا از تومور جدا شده و وارد رگهای خونی میشوند. در این مواقع درمان سرطان سختتر خواهد شد. تومورها از سه راه مختلف میتوانند به ارگانهای دوردست گسترش بیابند:
- ازطریق بافت: سرطان به بافت نرمال مجاور حمله میکند.
- ازطریق دستگاه لنفاوی: سرطان به دستگاه لنفاوی حمله و در عروق لنفاوی حرکت میکند و به دیگر نقاط بدن میرسد.
- ازطریق خون: سرطان به سیاهرگها و مویرگها حمله میکند و همراه خون به دیگر نقاط بدن میرسد.
خوشبختانه، اکثر این سلولها توسط سیستم ایمنی بدن از بین میروند اما تعداد اندکی که قادر به فرار هستند، زنده میمانند و ازطریق رگها وارد بافت میشوند. درنتیجه سلولهای عفونی میتوانند در بخشی دیگر از بدن نیز به تخریب بپردازند. در واقع تفاوت اصلی بین این دو تومور، عدم رخ دادن پروسهی متاستاز در تومورهای خوشخیم است. تومور خوش خیم معمولا پس از یک بار معالجه دیگر باز نمیگردد و ازطریق جراحی نسبت به حذف آن اقدام میشود. اگر سرطان پستان به استخوانها گسترش یابد، سلولهای سرطانی در استخوان در واقع سلولهای سرطان پستان هستند، و بیمای سرطان متاستازی پستان است و سرطان استخوان نیست.
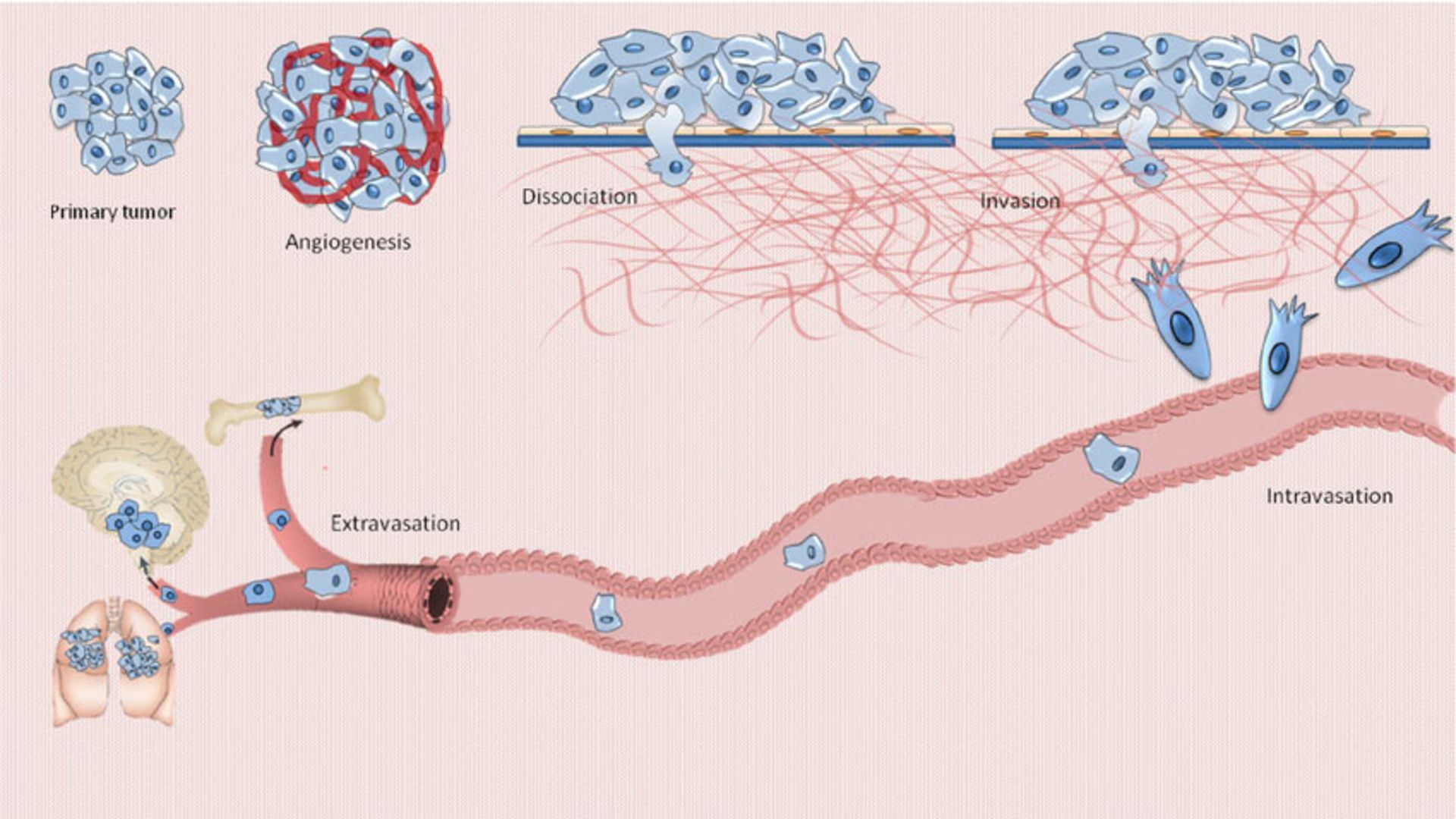
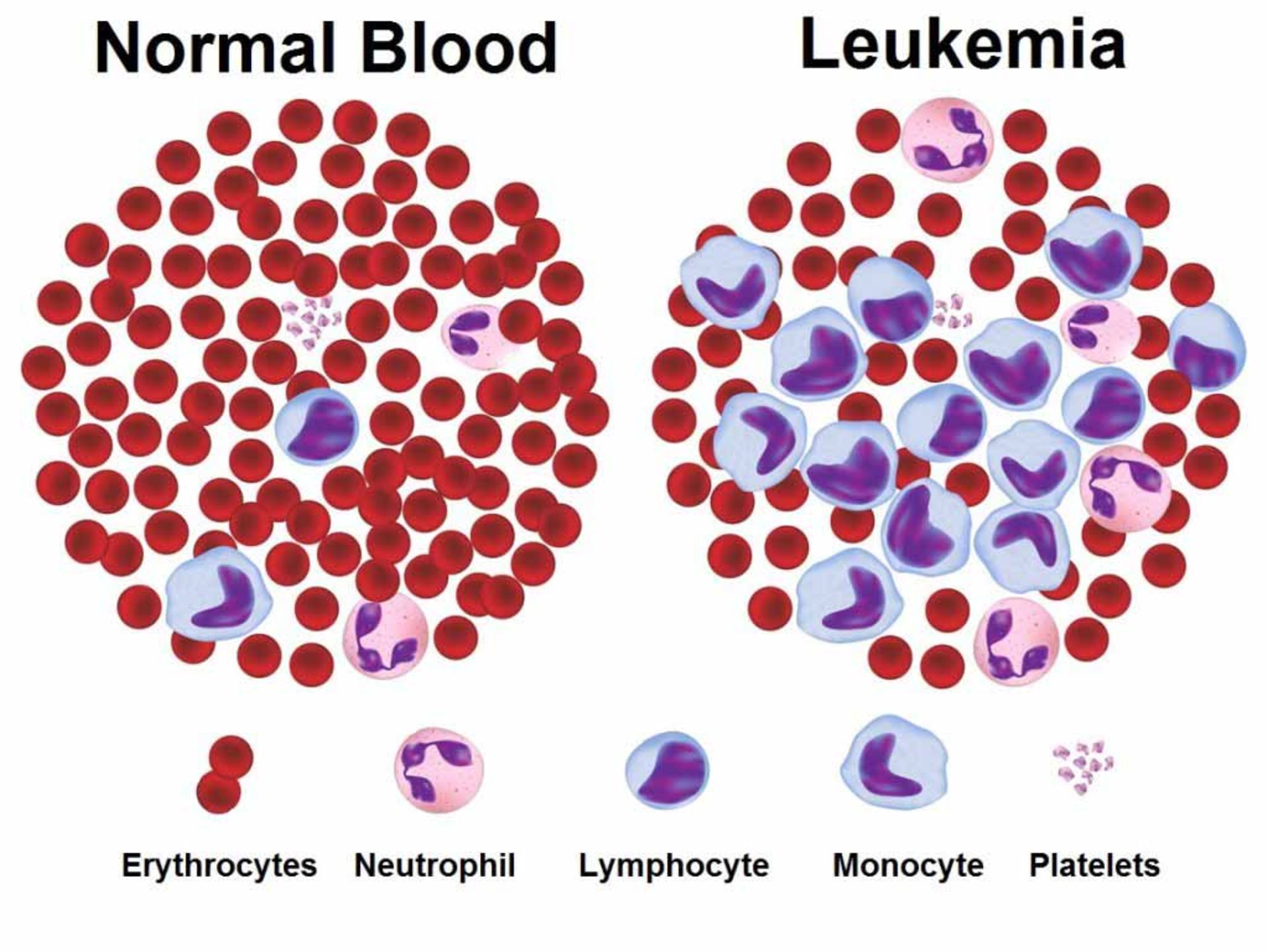
شکل بالا متاستاز را نشان میدهد. متاستاز (Metastasis) به گسترش و مهاجرت سلولهای سرطانی از یک بافت به بافتهای دیگر، گفته میشود. بسته به اینکه سلول سرطانی مربوط به کدام ارگان است، سرطان نامگذاری میشود؛ بهعنوان مثال اگر کبد آلوده شود سرطان کبد نام دارد و اگر سلول ریوی باشد، سرطان ریه، اگر سلول خون باشد، سرطان خون و غیره. سرطانهای بدخیم به دو دستهی سارکومها و کارسینومها تقسیم میشوند. انواع مختلفی از سرطانها وجود دارند و این سرطانها ممکن است در هر نوع سلول بدن ایجاد شوند. انواع سرطانها معمولا به نام اندام، بافت یا سلولهایی که در آنها به وجود میآیند، نامگذاری میشوند. رایجترین نوع سرطان، سرطان پوست است. سرطان پوست در بافت اپیتلیال، که خارج بدن، خطوط اندام، رگها و حفرهها را میپوشاند، ایجاد میشود. سارکوم نوعی از سرطان است که در عضله، استخوان و بافت نرم همبند از جمله چربی، عروق خونی، عروق لنفاوی، تاندونها و رباطها تشکیل میشود. لوسمی، سرطانی است که از سلولهای مغز استخوان که سلولهای سفید خون را تشکیل میدهند، سرچشمه میگیرد.
لنفوم در سلولهای سفید خون بنام لنفوسیتها ایجاد میشود. این نوع سرطان بر سلولهای B و سلولهای T تأثیر میگذارد. سلولهای سرطانی نسبت به سلولهای طبیعی، از گلوکز خیلی بیشتری برای رشدشان استفاده میکنند. گلوکز یک قند ساده است که برای تولید انرژی، طریق تنفس سلولی مورد نیاز است. سلولهای سرطانی با سرعت بالا از قند استفاده میکنند تا به تقسیم ادامه دهند. این سلولها انرژی خود را تنها ازطریق گلیکولیز به دست نمیآورند. گلیکولیز روند قطعهقطعه شدن قند برای تولید انرژی است. میتوکندری سلولهای تومور، انرژی مورد نیاز برای به وجود آمدن رشد غیرطبیعی مرتبط با سلولهای سرطانی را تأمین میکند. میتوکندری یک منبع انرژی تقویتشده ایجاد میکند که همچنین باعث میشود سلولهای تومور به شیمیدرمانی مقاومتر شوند.
سلولهای سرطانی از گلوکز زیادی نسبت به دیگر سلولها برای رشدشان استفاده میکنند
همهی ما از لقاح یک اسپرم و یک تخمک بهوجود آمدهایم. چند روز بعد از لقاح و وقتی تخمک بارور میشود، بر اثر فرایند تقسیم سلولی توپی متشکل از چند صد سلول بهوجود میآید؛ بدن ما از همین تقسیمهای سلولی ساخته میشود. زمانی که به بلوغ کامل میرسیم، بدن ما تریلیونها سلول دارد. تقسیم سلولی در بدن ما به صورت کاملاً کنترلشده انجام میشود حتی بعضی از سلولها عامدانه از بین میروند تا بدن ما صحیح شکل بگیرد. مثلا زمانی که در دوران جنینی دستهای ما بهوجود آمد، بعضی از سلولها در فرایندی به نام خزان یاختهای یا آپوپتوزیس خودکشی کردند تا فضای بین انگشتها ساخته شود. این تقسیم سلولی برای رشد و نمو ما ضروری است، بااینحال اگر تقسیمها از کنترل خارج شوند آن زمان است که مشکل ایجاد میشود. سلولهای سرطانی میتوانند با پنهان کردن خود در میان سلولهای سالم از سیستم ایمنی بدن اجتناب کنند.
بهعنوان مثال، برخی از تومورها پروتئینی ترشح میکنند که به وسیله غدد لنفاوی هم ترشح میشوند. این پروتئین به تومور اجازه میدهد تا لایهی بیرونیاش را به چیزی که شبیه بافتهای لنفاوی است تغییر شکل دهد. این تومورها به صورت بافت سالم و نه بافت سرطانی به نظر میرسند. درنتیجه، سلولهای ایمنی تومور را بهعنوان یک مادهی مضر تشخیص نمیدهند و تومور اجازه مییابد رشد کند و به شکل بیرویه در بدن گسترش یابد. سلولهای سرطانی دیگر با مخفی شدن در محفظههایی در بدن از داروهای شیمیدرمانی دوری میکنند. برخی از سلولهای لوسمی با پناه گرفتن در محفظههایی در استخوانها از درمان دوری میکنند. سرطان همان از دست رفتن کنترل سلولهاست. اگر بعضی از ژنهای کنترلکنندهی تقسیم سلولها مثل ژن p53 در سلولی دچار جهش شود، آن سلول سرطانی میشود و به صورت کنترلنشده شروع به تقسیم شدن میکند.
البته بدن ما برای یافتن این جهشها ابزارهایی دارد. بعضی مکانیسمهای بیولوژیکی در بدن ما وجود دارد که میتواند بیشتر سلولهای جهشیافته را قبل از اینکه مشکلی برای ما بهوجود آورند، نابود کند. بهگفتهی چارلز سوانتون از انستیتوی فرانسیس کریک در انگلستان، در پس این فرایند، میلیونها سال تکامل قرار دارد. این مکانیسم خیلی خوب عمل میکند ولی بینقص هم نیست. تهدید از جانب تعداد کمی از سلولها است که مکانیسم ترمیمی نمیتواند آنها را درست کند. در طول زمان یکی از این سلولهای افسار گسیخته میتواند آنقدر تقسیم شود که در نهایت غدهای متشکل از هزاران سلول را تشکیل دهد. در آخر وقتی تعداد آنها به میلیاردها رسید با یک تومور مواجه میشویم. وقتی انباشت سلولها تبدیل به تومور شد، فرد بهطور کامل به سرطان مبتلا شده است.
تومور باید خارج و همهی سلولهای سرطانی در آورده شوند. حتی اگر چند سلول باقی بماند، خیلی سریع ممکن است دوباره تقسیم شوند و تومورهای جدید بهوجود آورند. سلولهای سرطانی دستخوش تغییراتی میشوند تا از دفاعهای سیستم ایمنی اجتناب کنند، همچنین دربرابر اشعه و درمان شیمیدرمانی از خود نگهبانی کنند. برای مثال سلولهای اپیتلیال سرطانی، از شبیه شدن به سلولهای سالم با اشکال تعریف شده، به سمت شبیه شدن به بافت همبند سست میروند. توانایی تغییر شکل به غیر فعال شدن سوئیچهای مولکولیای به نام میکرو RNAها نسبت داده میشود. این مولکولهای RNA تنظیمی کوچک، توانایی تنظیم نحوهی بیان ژن را دارند. هنگامی که میکرو RNAهای خاص غیرفعال میشوند، سلولهای سرطانی توانایی برای تغییر شکل را به دست میآورند. یکی از نشانههای واضح سرطان افزایش سریع تشکیل عروق خونی جدید است که بهعنوان رگزایی شناخته میشود. تومورها برای رشد به مواد مغذیای که به وسیلهی رگهای خونی ارایه میشوند، نیاز دارند.
تومورها دائما از لحاظ ژنتیکی تغییر میکنند و به این دلیل درمان سرطان، سختتر میشود
اندوتلیوم عروق خونی هم مسئول رگزایی نرمال و هم رگزایی تومور است. سلولهای سرطانی سیگنالهایی به سلولهای سالم اطراف میفرستند و آنها را تحت تأثیر قرار میدهند تا عروق خونی جدیدی ایجاد کنند و سلولهای سرطانی را تأمین کنند. پژوهشها نشان دادهاند که وقتی از تشکیل عروق خونی جدید ممانعت میشود، رشد تومورها متوقف میشود. همهی سلولهای سرطانی شبیه به هم نیستند. وقتی یک سلول سرطانی تقسیم میشود، ممکن است دچار جهشهای ژنتیکی جدید شود که رفتار آن را تغییر میدهد. به بیان دیگر، سلول سرطانی تکامل پیدا میکند. وقتی که سلولهای درون یک تومور جهش پیدا میکنند، از نظر ژنتیکی بسیار گوناگون میشوند. سلولهای سرطانی هم درست مثل انسانها، شیرها، قورباغهها و باکتریها در طول زمان دچار تنوع ژنتیکی میشوند. نمیتوانید در یک تومور، دو سلول شبیه به هم پیدا کنید در یک تومور سلولهایی باقی میمانند که سرطانیتر هستند. ما با شاخههایی از تکامل دستوپنجه نرم میکنیم که تنوع را میسازند و تنوع باعث میشود تومور دربرابر درمان مقاومت کند.
در حقیقت از دلایلی که باعث میشود سرطان را بتوان سخت درمان کرد این است که تومورها دائما از نظر ژنتیکی تغییر میکنند. بههمیندلیل، دانشمندان میخواهند از در تکامل برای درمان سرطان وارد شوند. به تکاملی که در یک تومور سرطانی رخ میدهد به شکل درختی با شاخههای زیاد نگاه کنید. در پایهی درخت جهشهای ژنتیکی اولیهای قرار دارند که باعث فعال شدن تومور شدهاند؛ جهشهایی که بین همهی سلولهای تومور به اشتراک گذاشته میشوند و همهی آنها دارای آن جهش ژنتیکی هستند. به صورت نظری، درمانی که بتواند آن جهشهای اولیه را هدف بگیرد باید همهی سلولهای تومور را نابود کند. این روشی است که اکنون در بعضی درمانها استفاده میشود. مشکل اینجاست که این درمانها آنقدر که امید داریم خوب کار نمیکنند و معمولا تومور دربرابر آنها مقاومت میکند.
علایم سرطان
- تورم گردن و صورت: سرطان ریه می تواند باعث تورم در ناحیه صورت، گردن، بازوها و قسمت بالایی سینه شود و این زمانی است که یک تومور به رگی که از سر به قلب میرود فشار وارد میکند.
- ضعف عضلات: اگر انجام کارها مانند بلند کردن یک کتاب بزرگ یا بیرون آمدن از تخت خواب بهطورروزانه برای شما سخت است، این علامت میتواند نشانهی بیماری سرطان باشد.
- کاهش اشتها: از دست دادن اشتها یکی دیگر از نشانههایی است که میتوان بهراحتی آن را با مشکلات بیخطر مرتبط دانست؛ بااینحال اگر این وضعیت برای مدت طولانی ادامه پیدا کند یا با سایر نشانهها مانند نفخ همراه شود، به معاینهی فوری نیاز دارد.
- تغییرات پوست: وقتی متوجه تغییر در اندازه، شکل، رنگ یک خال یا لکههای دیگری روی پوست خود شدید، هرچه سریعتر به پزشک خود مراجعه کنید. لکههای جدید یا آنهایی که متفاوت به نظر میرسند، مهمترین علایم سرطان پوست بهحساب میآیند.
- خونریزی غیرطبیعی: اگر دچار خونریزی غیرطبیعی در هر جای بدنتان از جمله دهان، انتهای روده، واژن یا مجرای ادرار شدهاید، فورا به پزشک مراجعه کنید. اگر بعد از عمل سزارین یا بین دو دورهی قاعدگی متوجهی خونریزی شدید، احتمال سرطان رحم وجود دارد.مقالهی مرتبط:معرفی روش درمان جدید برای سرطان سینه تهاجمی
- کاهش وزن ناگهانی: کاهش وزن ناگهانی میتواند از نشانههای سرطان معده باشد که البته تشخیص این نوع از سرطان در مراحل اولیهی ابتلا به آن بسیار دشوار است. گاهی سلولهای سرطانی از بافت اولیهای که در آن ایجاد شدهاند جدا میشوند و از راه جریان خون یا سیستم لنفاوی خود را به دیگر اعضای بدن میرسانند و در محل جدیدی تکثیر میشوند و کانون سرطانی جدیدی میسازند.
- خستگی: ضعف و خستگی که با استراحت یا خواب کاهش نمییابد، باید توسط پزشک بررسی شود و ممکن است نشانهای از سرطان باشد که البته پزشک باید با توجه به نشانههای دیگر آن را بررسی کند.
- سرفههای شدید: سرفههای طولانی میتواند خطر جدی برای سلامت شما باشد. سرفه معمولا میتواند به این معنا باشد که در دستگاه تنفسی شما اشکالی وجود دارد اما اگر صدایتان ناهنجار و خشن شود یا همراه با سرفه خون ببینید، داستان متفاوت است.
- وجود توده: بدن خود را لمس کنید و اگر در جایی تودهای حس کردید، هرچهقدر هم که کوچک باشد، برای بررسی آن به پزشک مراجعه کنید. هر تودهای که در حال تغییر است باید توسط پزشک بررسی شود. تودهها در پستان و البته بیضه بهترتیب علائم بسیار شایع سرطان پستان و پروستات هستند.
- نفخ: نفخ بیدلیل و طولانی مدت میتواند یکی از نشانههای سرطان تخمدان باشد. نفخ شکم همراه با درد لگن، ورم رودهها و احساس پر بودن شکم نیز ممکن است از دیگر نشانهها باشد. همچنین درد یا نفخ معده پس از خوردن ممکن است نشانهی سرطان معده باشد.
عوامل ایجاد سرطان

پارازیتها
پارازیت، موج الکترومغناطیسی از نوع مایکروویو است که از جنس همان امواج ماهواره است ولی قویتر از آن. چرا دربارهی پارازیتهای ماهوارهای سالهای اخیر نگرانین هستیم؟ تفاوت این امواج با سایر امواج چیست؟ تفاوت امواج الکترومغناطیس به میزان طول موج، فرکانس و قدرت انرژی آنها است. طول موج امواج مایکروویو از امواج رادیویی کمتر است، در عوض فرکانس و انرژی آنها بیشتر است. پژوهشها و نظرهای زیادی دربارهی تأثیر منفی امواج مایکروویو، تلفن همراه و حتی اجاقهای مایکروویو بر سلامت وجود دارد، اما تأثیر امواج پارازیت چطور؟
مواد آرسنیکدار
تصور عام بر این است که تنها نور آفتاب برای پوست افراد مضر است و سرطانزا است در حالیکه مواد آرسنیکدار نیز این قابلیت را دارند. موادی که در آن ترکیبات آرسنیکدار وجود داشته باشد در صورت تماس با پوست میتوانند منجر به سرطانهای پوستی شوند. شاید جالب باشد بدانید آرسنیک در جنگ جهانی دوم برای درمان سرطان استفاده میشده است. این ماده در آب، خاک و بستر سنگها یافت میشود و در صنعت نیز برای ساخت چوب حشرهکش، شیشه، آلیاژها به کاربرد میرود. آرسنیک در آب آشامیدنی هم وجود دارد که میزان استاندارد آن ۵۰ در یک بیلیونیوم است. آرسنیک شبهفلز خاکستری نقرهای رنگی است که به صورت معدنی و در آب وجود دارد. متخصصان آنکولوژی معتقد هستند در مناطقی که فرسایش خاک بسیار است میزان آرسنیک موجود در هوا زیادتر از حد معمول است و بدین ترتیب مردم این مناطق بیشتر درمعرض ابتلا به سرطانهای پوست، ریه، مجای ادراری، سرطان کلیه قرا دارند. همچنین گزارش شده است که برخی برنجهای وارداتی و همچنین برنجهای داخلی آلوده به آرسنیک هستند.
آلایندههای هوا
سارکوم نوعی از سرطان است که در عضله، استخوان و بافت نرم همبند تشکیل میشود
از دیگر عوامل محیطی میتوان به اشعههای موجود در محیط و ترکیبات یونیزه اشاره کرد، هرچند که اینها به صورت ناخواسته در هوا پراکنده هستند اما بسیار مخرب محسوب میشوند. گزارشها اخیر حاکی از آن است که گردوغبارهای حاصل از اقدامات صنعتی علاوه بر اینکه باعث بروز بیماریهای قلبی عروقی میشوند میتوانند سرطان مجاری تنفسی را به همراه داشته باشند. آژانس حفاظت از محیط زیست آمریکا (EPA)، طی گزارشی در سال ۲۰۰۹ منتشر کرد که نقطهی عطفی در خصوص برآورد غلظت آلایندههای هوا به شمار میآمد. در این گزارش بیش از ۱۸۱ آلایندهی مختلف موجود در هوا مورد مطالعه قرار گرفتند که از این میان ۸۰ آلاینده به شکلگیری سرطان در انسان کمک میکنند. بهعنوان مثال تنفس بنزن آزاد شده از اگزوز اتومبیلها میتواند منجر به سرطان شود در واقع حدود ۳۰ درصد از سرطانهای ناشی از هوای آلوده به دلیل دود ماشینها هستند، ۲۵ درصد دیگر از سرطانها به دلیل آلودگیهای صنعتی و کارخانهای است.
مکملها و مولتیویتامینها
فقط افراد مبتلا به کمبود ویتامین و مواد معدنی و زنان باردار مجاز به استفاده از مکملها هستند. در سال ۲۰۱۰ آژانس تحقیقات سلامت ایالات متحده با بررسی ۶۳ پژوهش گسترده به این نتیجه رسید که استفاده از مولتیویتامینها هیچ تأثیری در پیشگیری از ابتلا به سرطان و بیماری قلبی در بین اکثر مردم جهان ندارند. در عوض استفاده از بعضی از مکملها مانند ویتامین E، بتاکاروتین و ویتامین C میتوانند به سلامت بدن آسیب وارد کنند و خطر ابتلا به بیماری را افزایش دهند.
بسیاری از مردم معتقدند آنتیاکسیدانهایی مانند ویتامین E میتوانند با رادیکالهای آزاد و مضر بدن که بر اثر عواملی مانند سیگار کشیدن، نور آفتاب و مصرف غذاهای چرب بهوجود میآیند، مبارزه کنند. حقیقت این است که از بین بردن کامل این رادیکالهای آزاد کار درستی نیست. بدن در بعضی موارد این رادیکالهای آزاد را تولید میکند تا با سلولهای مضر از جمله سلولهای سرطانی مبارزه کند. اگر شما با مصرف دائمی ویتامینها این مکانیسم را متوقف کنید، بدن توانایی طبیعی کنترل خود را از دست میدهد. بنابراین بهتر است به جای آنکه پول خود را صرف خرید مکملهای گرانقیمت کنید، غذاهای سالم و باکیفیت بهتر تهیه کنید.
غذاهای کنسروی
تقریباً بیشتر غذاهای کنسروی را میتوان جزو موادغذایی ناسالم محسوب کرد چون در ساخت قوطی کنسرو از یک مادهی شیمیایی به نام بیسفنول-A یا BPA استفاده میکنند. در همین زمینه پژوهشهایی توسط آکادمی ملی علوم آمریکا در سال ۲۰۱۳ انجام شد و نتایج آن به این صورت بود که BPA حتی روی ژنهایی که داخل مغز موشهای فاضلابی کار میکنند نیز تأثیر مخرب میگذارد. حتی سازمان غذا و داروی آمریکا چنان تحت تأثیر BPA قرار گرفته است که خواستار جایگزین کردن قوطیهای کنسرو یا حداقل کاهش دادن تولیدهای کنسروی شده است. خود گوجهفرنگی به خاطر خاصیت بالای اسیدیاش، کار را خطرناکتر هم میکند. این خاصیت اسیدی باعث میشود تا BPA موجود در جدارهی داخلی قوطی کنسرو راحتتر متساعد شود و به داخل گوجهها برود. براساس قوانین سازمان غذا و داروی آمریکا هیچ برچسبی تعریف نشده وجود ندارد که نشان دهد این قوطیها دارای BPA هستند.
میوهها و سبزیجات غیرارگانیک
طی مرحلهی متاستاز، سلولهای سرطانی به دیگر بخشهای بدن نیز سرایت میکنند
میوهها و سبزیجات غیرارگانیک آلوده به سمومی مانند آترازین، تیودیکارب و ارگانوفسفات هستند تا از دست آفتها در امان بمانند. همچنین این نوع میوه و سبزیها را تا حد زیادی به کود نیتروژن آغشته کردهاند. آترازین مادهای است که دراروپا بهکارگیری آنرا ممنوع کردهاند زیرا برای تواناییهای تولید مثلی انسان مضر است. در سال ۲۰۰۹، نتایج تحقیقات نشان داد که اگر زن حاملهای یک لیوان آب آلوده به آترازین بنوشد، از وزن بچهاش در هنگام تولد کم خواهد شد. گفته میشود سبزیهایی که از ورامین به تهران میآورند با فاضلاب آبیاری میشوند که در دراز مدت باعث بروز سرطان دستگاه گوارش میشود. بااینحال، سونامی سرطانی که کارشناسان ایرانی از چند سال قبل پیشبینی کردهاند، چندان هم دور از ذهن نیست.
شکر تصفیهشده
شکر تصفیه شده میتواند یکی دیگر از مواد سرطانزا به شمار رود. هر مادهای روی آن عملیات پالایشی صورت گرفته باشد معمولا اثرات طبیعی خودش را از دست میدهد و باعث مشکلات بعدی در بدن میشود. علاوهبراین مشکل نباید از شکر بهعنوان یک افزودنی همیشگی استفاده کنید، شکر بهعنوان قند وارد بدن شما میشود و برای کسانی که مشکلات انسولینی دارند، یک خطر بزرگ محسوب میشود و از طرفی این ماده یکی از منابع تغذیهی سلولهای سرطانی است. سودا هم بهعنوان یکی از فراوردههای لاکتوزی در نوشابهها معمولا استفاده میشود که خود سرطانزا محسوب میشود. اسید موجود در نوشابهها هم سرطانزا است. بنابراین برای کنترل احتمال سرطان در بدن خودتان باید مصرف قند و شکر خودتان را کنترل کنید و از موادی که قند طبیعی در خودشان دارند استفاده کنید؛ هرچقدر از انواع شکرها دور بمانید بهتر است.
گوشتهای فرآوریشده

گوشتهای فرآوریشده به آن دسته از فرآوردههای گوشتی گفته میشود که از طرق مختلف مانند دودی یا نمک سود کردن یا افزودن مواد نگهدارنده مدت مصرف آنها افزایش مییابد یا مزه آنها تغییر میکند. سازمان جهانی بهداشت میگوید که مصرف گوشتهای فرآوریشده مانند بیکن، سوسیس، کالباس و ژامبون، باعث بروز سرطان میشود. در گزارشی که این سازمان منتشر کرده، آمده است که مصرف ۵۰ گرم گوشت فرآوریشده در روز میتواند خطر ابتلا به سرطان روده بزرگ را تا ۱۸ درصد افزایش دهد. میزان فراوان نمک و مواد شیمیاییای که در راستای تولید کردن گوشت فرآوریشده به آن افزوده میشود، برای سلامتی انسان مضر است. نتایج پژوهشهایی که آنها انجام دادهاند نشان میدهد که بهطور میانگین از هر ۱۷ نفری که در این تحقیق شرکت کرده بود ۱ نفرشان مرد و آنهایی که روزی ۱۶۰ گرم از این سوسیس کالباسها خوردند، تا ۱۲ سال آینده، احتمال مرگشان ۴۴ درصد بیشتر از کسانی است که روزی ۲۰ گرم یا کمتر گوشت فرآوریشده خورده بودند. این پژوهش با شرکت افرادی از ۱۰ کشور اروپایی، در یک بازهی زمانی ۱۳ ساله انجام شد.
مواد غذایی شور یا دودی
مواد غذایی که با استفاده از نیتراتها یا واکنشهای نیتراتی شور شدهاند. نه اینکه نیترات به خودی خود عامل سرطانزا باشد، اما تحت شرایط خاص، وقتی این مواد شیمیایی وارد بدن میشوند به کامپوزیتهای N-nitroso تبدیل میشوند. این کامپوزیتهای N-nitroso سرطانزا هستند. دودی کردن غذاها مثل ماهی دودی یا گوشت دودی، باعث میشود تا این غذاها مقادیر زیادی قطران، همان سمی که در سیگار موجود است، جذب کنند. قطران بهعنوان مادهای سرطانزا شناخته میشود. شواهد نشان میدهد که مصرف این نوع غذاها بهشدت احتمال ابتلا به سرطان رودهی بزرگ و همینطور سرطان شکم را بالا میبرند. در کشورهایی مثل ژاپن که مردم به صورت سنتی غذاهای شور زیاد مصرف میکنند آمار سرطان شکم خیلی بالا است.
نشستن طولانیمدت
شاید عجیب به نظر برسد، اما علت ابتلای درصد زیادی از افراد به بیماری سرطان، نشستن طولانیمدت بوده است. نشستن طولانی مدت میزان تریگلیسرید، کلسترول، فشار و قند خون را افزایش میدهد و ترشح هورمون اشتها را بیشتر میکند. پژوهشهای انجامشده توسط جامعهی سرطان ایالاتمتحده در سال ۲۰۱۰ نشان داد، نشستن بیش از ۶ ساعت در روز درست به اندازهی سیگار کشیدن و حتی بیشتر از آن میتواند به سلامت انسانها آسیب وارد کند. البته زنان بیشتر از مردان بر اثر نشستنهای طولانیمدت آسیب میبینند که دلیل احتمالی آن هم فعالیت هورمونهای زنانه مانند استروژن است. برای مثال زنانی که عادت به نشستن طولانیمدت دارند با احتمال ۳۷ درصد بیشتر از زنانی که کمتر از ۳ ساعت در روز مینشینند، ممکن است ظرف ۱۳ سال آینده به سرطان دچار شوند. این آمار برای مردان حدود ۱۸ درصد است که نشان میدهد میزان خطر برای آنها کمتر است.
کامپوزیتهای N-nitroso که از نیترات به وجود میآیند، سرطانزا هستند
آبیموههای صنعتی
قبلا تصور میشد نوشیدن یک لیوان آبمیوه بهترین روش برای شروع روز است. اما دانشمندان معتقدند مصرف بعضی از آبمیوهها نهتنها مفید نیستند، بلکه خطر مبتلا شدن به سرطان را هم افزایش میدهند. آبمیوههای صنعتی به قدری شکر دارند که بدن را برای جذب و حتی دفع این مقدار با مشکل مواجه میکنند. در حقیقت طی روند تولید و بستهبندی آبمیوهها، بخش زیادی از ترکیبات ضدسرطان آنها از بین میرود. دانشمندان استرالیایی تصمیم گرفتند تأثیر مصرف میوهها، سبزیجات و انواع مختلفی از آبمیوهها را در پیشگیری از سرطان بررسی کنند. بعد از انجام پژوهشها روی ۲ هزار و ۲۰۰ نفر، آنها متوجه شدند خوردن میوههایی مانند سیب و گلابی و سبزیجاتی مانند کلم بروکلی و گلکلم احتمال ابتلا به سرطان را کاهش میدهد اما در عوض نوشیدن آبمیوههای صنعتی این احتمال را افزایش میدهد.
این پژوهشها همچنین نشان داد افرادی که بیش از سه لیوان در روز از این آبمیوهها مصرف میکنند با احتمال بیشتری به یکی از انواع سرطانهای روده دچار میشوند. در هنگام تولید آبمیوههای صنعتی بخش مهمی از مواد ضدسرطان مانند فیبر، ویتامین C و مواد شیمیایی موسوم به آنتیاکسیدانها از بین میروند. در عوض شکر زیادی در این نوع آبمیوهها مصرف میشود که ممکن است به رشد تومورهای سرطانی کمک کند. البته آبمیوههای کاملاً طبیعی هم شکر زیادی دارند، اما به دلیل داشتن مواد ضدسرطان استفاده از آنها به انواع صنعتی و دیگر نوشابهها ارجحیت دارد.
برخی ویروسها
سلولهای سرطانی ممکن است درنتیجه برخی از عوامل از جمله قرار گرفتن درمعرض مواد شیمیایی، اشعه، نور ماورای بنفش و خطا در تکرار کروموزوم ها ایجاد شود. علاوه بر این، ویروسها این توانایی را هم دارند که با تغییر ژنها باعث سرطان شوند. این ویروسها با یکپارچهسازی مواد ژنتیکی خود با DNA سلول میزبان، سلولها را تغییر میدهند. ژنهای ویروسی رشد سلول را تنظیم میکنند و به سلول توانایی انجام رشد غیرطبیعی را میدهند. ویروس پاپیلومای انسانی (HPV) که باعث ایجاد زگیل در نواحی تناسلی میشود، مسبب سرطان دهانه رحم است و ویروس Epstein-Barr که عفونت مونونوکلئوز را ایجاد میکند، عامل سرطان لنفوم بورکیت است.
اساس سلولیمولکولی سرطان
در سال ۲۰۰۳ توسط پروژهی ژنوم انسان، تمام ژنهای انسان توالییابی شدند که برای اولین بار مشخص شد فقط ۲۳۵۰۰ ژن فعال در هستهی هر سلول سوماتیک وجود دارد. این ژنهای فعال در حدود ۴۰۰ هزار نوع پروتئین را برای بدن میسازند که بهصورت پروتئین، آنزیم، هورمون، سیتوکین و مولکولهای گیرنده در بدن وجود دارند. این تنوعهای مولکولی باعث تغییرات در ظاهر و داخل بدن انسان میشود. سرطان یک بیماری ژنتیکی است که ۲۷۷ نوع بیماری را شامل میشود. همچنین در محیط زیستی ما بیش از یک صد هزار نوع مواد شیمیایی وجود دارد که فقط ۳۵ هزار از آن بررسی شده است و حدود ۳۰۰ عدد از آنها تولید سرطان میکنند. هنوز ۶۵ هزار مواد شیمیایی باقیمانده در طبیعت آزمایش نشده است.
سرطان روابط و نظم بین سلولی را مختل میکند و باعث نافرمانی ژنهای حیاتی میشود
۹۳ درصد سرطانها زاییدهی محیط زیست، ۳۰ درصد از دود سیگار، ۳۵ درصد از رژیم غذایی، ۲۵ درصد از بیماریهای عفونتی و ۱۰ درصد از اشعههای یونی و غیریونی است. سرطانها توسط یک سری جهشهای متوالی در ژنهای انسان اتفاق میافتد و هر موتاسیون هم تا حدی تغییرات جدیدی را در سلول بهوجود میآورد. مواد شیمیایی باعث ایجاد سلولهای سرطانی به نام کارسینوژن میشوند. دود سیگار در حدود ۴۰ مادهی شیمیایی کارسینوژنیک دارد که اغلب تولید سرطان شش میکنند. در طبیعت بیش از ۱۰۰ هزار نوع مواد شیمیایی وجود دارد که بهطور مستقیم یا غیرمستقیم اثرات و صدمات خود را در ستیوپلاسم و هستهی سلولها وارد میکنند و منجر به اختلالات ژنتیکی میشوند و سرانجام جهشها را بهوجود میآورند.
ویروسها، باکتریها و اشعههای مختلف هم باعث ایجاد سرطانهای وراثتی میشوند که تعداد آنها در حدود ۷ درصد کل سرطانها است. بافتهای سرطانی به ۶ گروه تقسیم میشوند: خون، غدد لنفاوی، سارکوما، کارسینوما، سلولهای جنینی، سلولهای جنسی. سرطان یک بیماری است که روابط و نظم بین سلولی را مختل میکند و باعث نافرمانی ژنهای حیاتی و کلیدی میشود. این بینظمیهای مولکولی در سیکل تقسیم سلولی اثر دارد و منجر به عدم تمایز سلولی میشود. ژنهای کلیدی که معیوب میشوند و عملکرد آنها تغییر میکنند به چهار گروه تقسیم میشوند:
۱. انکوژنها
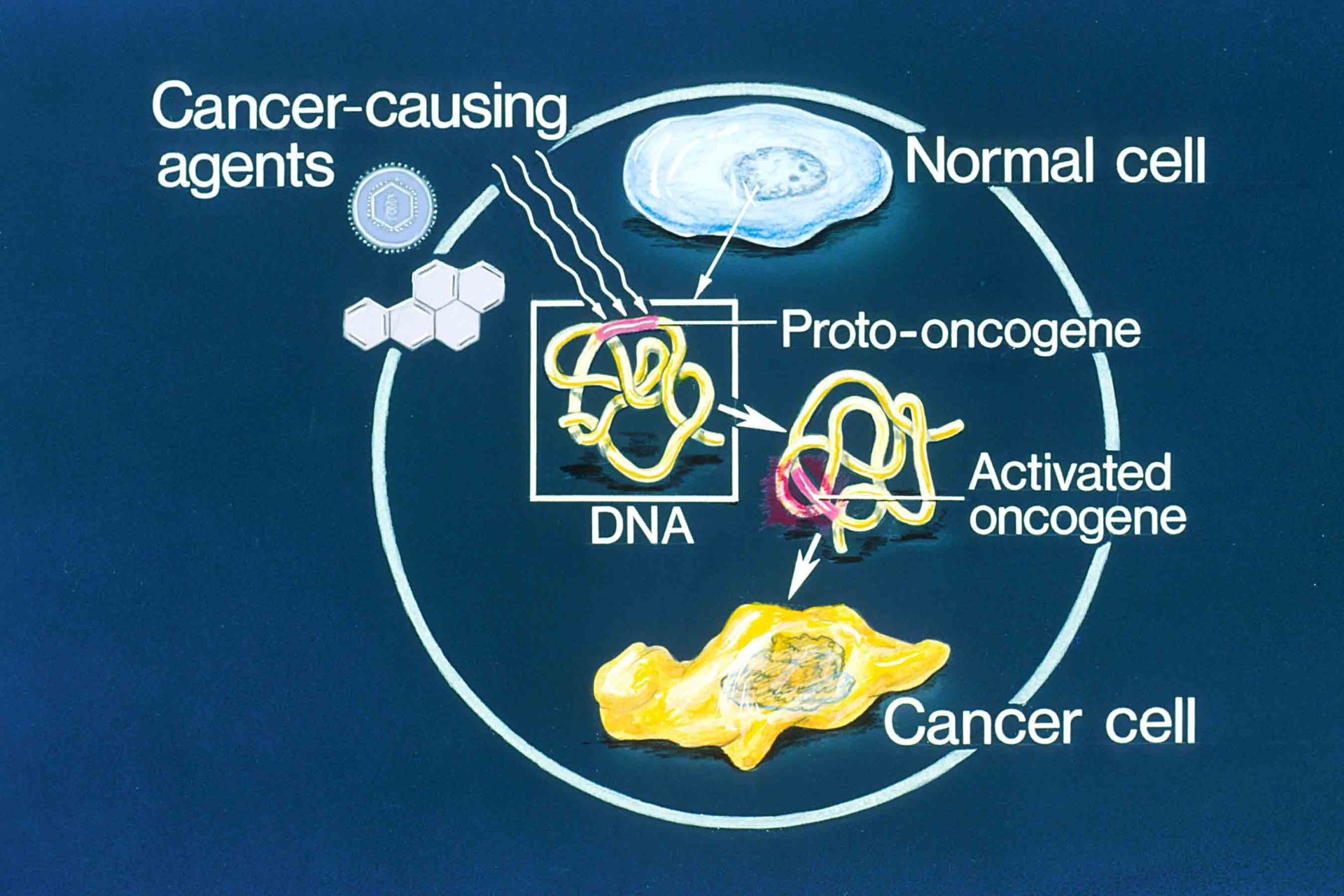
انکوژنها (Oncogene) اولین ژنهای سرطانی بودند که کشف شدند. انکوژنها یا ژنهای تومورزا ژنهای تغییر یافتهای هستند که در حالت عادی پروتئینهایی را که در کنترل رشد و تکثیر سلولها نقش دارند، بیان میکنند. این ژنها در حالت عادی پروتوانکوژن نامیده میشوند ولی در صورت بروز جهش در پروتوانکوژنها، آنها به انکوژنها تبدیل میشوند.
جهشهایی که پروتوانکوژنها را به انکوژنها تبدیل میکنند، اغلب باعث بیان بیش از حد فاکتورهای کنترلی، افزایش تعداد ژنهای کدکنندهی آنها یا تغییر فاکتورهای کنترلی بصورتیکه فعالیت فاکتورها، افزایش یابد یا نیمه عمر آنها در سلول زیاد شود، میشود. ابتدا انکوژنها در ویروسها کشف شدند که انکوژنهای ویروسی نامیده میشوند. بهواسطهی جهش در پروموتر پروتوانکوژنها، آنها به انکوژنهای فعال تبدیل، بیان آنها زیاد میشود، تکثیر سلولها افزایش مییابد و تومور ایجاد میشود.
آنکوپروتئین
آنکوپروتئینها محصول پروتوانکوژنها هستند که در حضور ژن سرکوبگر تومور ایجاد میشوند. در سلول های دیپلوئیدی طبیعی دو کپی از هر ژن سرکوبگر وجود دارد. هر دو ژن اغلب غیر فعالاند. انکوپروتئینها نقشهای زیادی دارند؛ بعضی بهعنوان لیگاند عمل میکنند و در سطح سلول گیرنده دارند و مانند فاکتورهای رشد عمل میکنند. برخی از آنها نیز بهعنوان گیرندههای غشایی عمل میکنند.
پروتوانکوژن
پروتوانکوژنها ژنهایی هستند که برخی از آنها فاکتورهای رشد سلول، رسپتورهای فاکتورهای رشد، فاکتورهای رونویسی و فاکتورهای کنترلکنندهی سیکل سلولی را کد میکنند. برخی از ویروسها دارای ژنهایی مشابه انکوژنهای سلولی هستند و در صورتی که این ویروسها وارد سلولهای عادی شوند با بیان انکوپروتئینها، باعث سرطانی شدن سلولها میشوند. انکوژنهای ویروسی را بهصورت v-onc نشان میدهند. برای مثال، ویروس Rous Sarcoma دارای v-scr و ویروس Rat sarcoma دارای v-ras است. محصول پروتوانکوژنها را انکوپروتئین مینامند. تغییرات ژنتیکی که باعث تولید آنکوژنها و اختلالات ژنتیکی میشود عبارتاند از:
- Chomosomal Translocation: مانند ژن Bcr و انکوژن Abl در سرطان مزمن خون
- Point mutation: مانند ژن Ras در سرطان روده بزرگ
- Deletion: مانند ژن Erb-B در سرطان سینه خانمها
- Amplification: مانند ژن N-myc در سرطان سلولهای عصبی کودکان
- Insertional activation: مانند ژن C-myc در سرطان حاد خون
سرطان مزمن خون اغلب در سنین بالا اتفاق میافتد و شامل تعویض مادهی ژنتیکی دو کروموزوم ۹ و ۲۲ است. این حالت منجر به تولید یک بیومارکر بهنام (ph1) که در ۹۵ درصد این بیماران دیده میشود که به تشخیص صحیح نوع بیماری کمک موثری میکند. اتصال ژن Bcr به آنکوژن Abl باعث بهوجود آمدن ترکیب جدید ژنی میشود که پروتئین حاصل و ساختهشده از آن، خاصیت پروتئین کیناز (protein kinase) دارد. در سال ۱۹۹۰ شکل فضایی و سهبعدی این آنزیم مشخص و داروی Gleevec توسط سازمان FDA آمریکا تصویب شد. این دارو Gleevec یا Imatinib نام دارد که از مادهی شیمیایی 2-phenylamino pyrimidine ساخته شده است. مکانیسم عمل این دارو به این نحو است که به محلهای فعال آنزیم یادشده میچسبد و باعث جلوگیری از فعالیت این آنزیم میشود که نهایتا منجر به عدم رشد سلول سرطانی میشود. این اولین داروی ضدسرطانی است که منحصرا آنزیم سلولهای سرطانی را هدف قرار میدهد. این دارو همچنین روی تومورهای دستگاه گوارش و دستگاه تولیدمثل هم مؤثر بوده است و آنزیمهای تولیدشده توسط ژنهای Erb-B ،Kit و EGFR را هدف قرار میدهد.
۲. مرگ برنامهریزیشده (آپوپتوزیس)
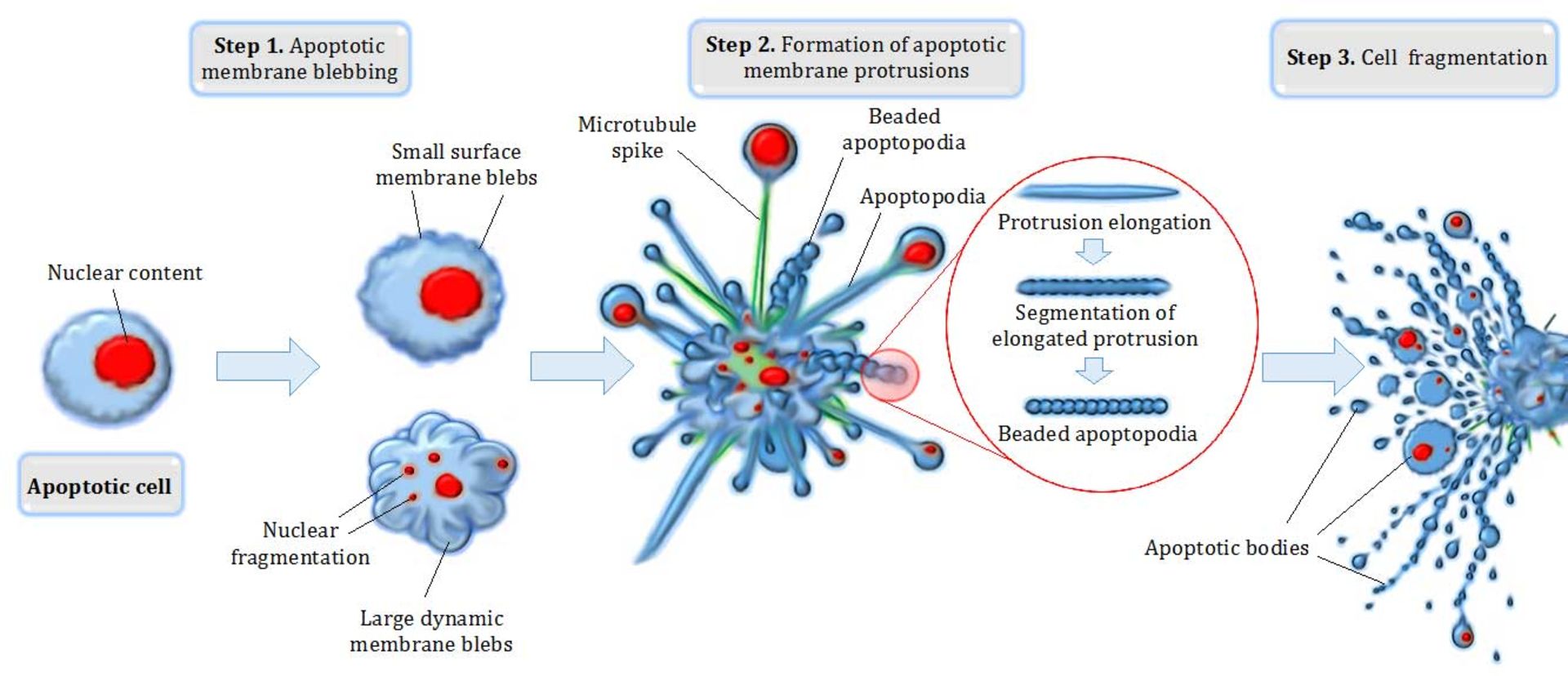
آخرین راه فرار از سرطانی شدن سلولها انتخاب مرگ یا خودکشی برنامهریزی شده (Apoptosis) است. تخریب غشای هسته و سیتوپلاسم سلول منجر به قطعهقطعه شدن سلول میشود که سریعا توسط فاگوسیتها بلعیده و از محیط ربوده میشوند. در یک انسان بهطور میانگین هر روز ۶۰ میلیون سلول با مرگ برنامهریزیشده میمیرند. ازدیاد عمل در این مرگ باعث تحلیل بافتها و فقدان عمل موجب تولید سلولهای سرطانی میشود. عوامل زیادی سبب تولید این خودکشی سلولی میشود که از آن جمله میتوان به توکسینها، هورمونها، سیتوکینها، اشعهها، حرارت، عفونت ویروسی، کمبود اکسیژن، محرومیت غذایی، ازدیاد غلظت کلسیم داخل سلول و نیتریک اکسیدها اشاره کرد. چندین ژن در تولید آپوپتوزیس نقش مهمی را ایفا میکنند، مانند Bcl-2, P53, Bcl-XL, Bax, Bak, Bad, Bim و Mcl-1. ژن Bcl-2 روی کروموزوم 18q21 قرار دارد که وزن مولکولی پروتئین آن ۲۵ کیلودالتون و طولش ۲۳۹ اسیدآمینه است.
این پروتئین فعالیت آنزیمهای کاسپاز را تنظیم میکند. این پروتئین Bcl-2 باعث رهایی سیتوکروم C از میتوکندریها که منجر به فعال شدن کاسپاز ۹ و سپس کاسپاز ۳ و در نهایت به خودکشی سلول ختم میشود. پروتئین Bcl-2 میتواند هم در ایجاد و هم ممانعت از آپوپتوزیس نقش بازی کند. همکاری پروتئینهای Mcl-1 ،Bcl-2 و Bcl-XL عمل ضدآپوپتوزیس دارند. درحالیکه دیگر پروتئینهای Bax, Bak, Bad, Bim در ایجاد آپوپتوزیس نقش موثری را بازی میکنند. برای جلوگیری از آپوپتوزیس باید از عمل Fas و Bcl-2 جلوگیری کرد و غلظت IAPS را بالا برد. همچنین پروتئین AKt-kinase باعث بقای زندگی سلولها میشود. فسفوریلاسیون ژن Akt باعث جلوگیری از عمل Bax و پروتئین Akt باعث فعال شدن مولکول IKKA میشود که این امر مولکول NF-KB را فعال میکند و در نهایت منجر به بیان ژنهایی میشود که ضد آپوپتوزیس هستند.
آخرین راه فرار از سرطانی شدن سلولها، انتخاب آپوپتوزیس است
۳. ژنهای ترمیمکننده
ژنهای ترمیمکننده بهطور طبیعی پروتئینها و آنزیمهایی را میسازند که خاصیت ترمیمکنندهی ژنهای صدمه دیده را دارند. هنگامی که خودشان موتاسیوندار شوند آن موقع نمیتوانند نواقص ژنهای دیگر را بازسازی کنند. همهی ژنهای سلول بهطور طبیعی تحت حملات عوامل محیطی و متابولیکی قرار میگیرند که نتیجهی صدمات متوالی به این ژنها نیاز مبرمی نسبت به پروتئینهای ترمیمکننده پیدا میکنند. تا بهحال بیش از ۳۰ نوع پروتئینهای ترمیمکننده شناسایی شدهاند که همگی در تصحیح نواقص ژنتیکی سلولها نقش زیادی دارند. بیش از یک میلیون صدمات ژنتیکی در روز به ژنهای هر سلول زده میشود که اگر این نواقص ترمیم نگردد سلول یا سالخورده میشود، یا خودکشی میکند یا به سرطان تبدیل میشود. بهترین مثال ژن ترمیمکننده، ژن BRCA-1 است که روی کروموزوم 17q21 قرار دارد.
این ژن پروتئینی میسازد که چندین خاصیت دارد که یکی از این خواص، قدرت تصحیح ژنهای معیوب است. این پروتئین حاوی مولکول Zinc finger است که بیان ژنهای وابسته را کنترل میکند. پروتئینهای BRCA-1 و RDA-1 میتوانند شکستگیهای دو رشته DNA را تعمیر کند. ژن BRCA-1 در هنگام موتاسیون داشتن به تولید و رشد سلولهای سرطان در سینه خانمها بهصورت وراثتی نقش موثری دارد. ژن BRCA-2 هم که روی کروموزوم 13q14 است پروتئینی تولید میکند که همانند پروتئین BRCA-1 عمل میکند. تا به حال بیش از یک هزار موتاسیون ژنتیکی در ژن BRCA-2 و BRCA-1 شناسایی شده است. ژن BRCA-1 در سال ۱۹۹۰ توسط Dr.king کشف و در سال ۱۹۹۴ کلون شد.
۴. ژنهای سرکوبگر توموری
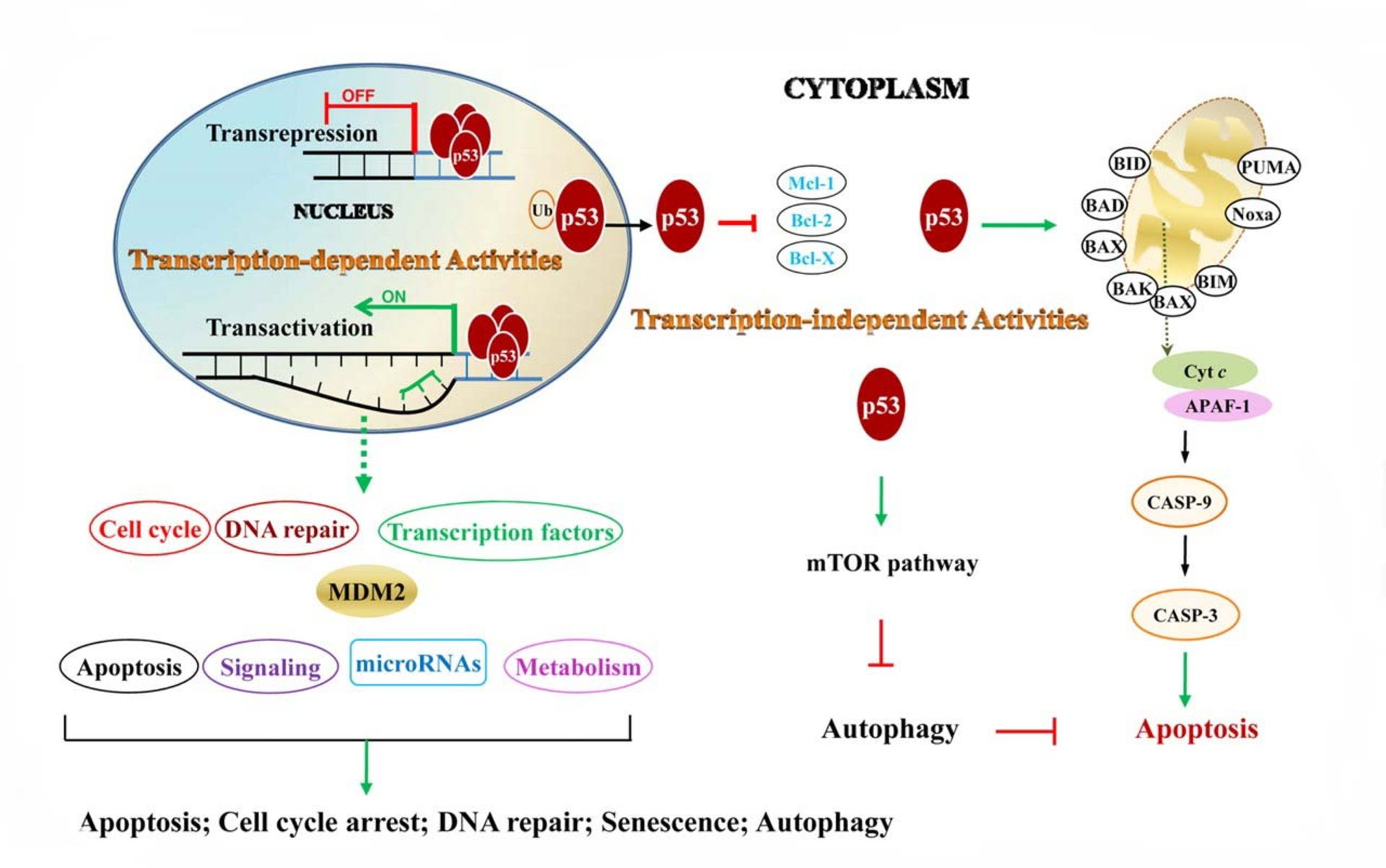
نبود ژنهای مهارکنندهی توموری یا سرکوبگر توموری باعث تقسیم غیرقابل کنترل سلولهای سرطانی میشود. ژن مهارکنندهی p53 روی کروموزوم 17P13.1 قرار دارد. طول این ژن ۲۰ هزار bps است که پروتئین به طول 393 اسید آمینه میسازد. ژن P53 که در سال ۱۹۹۳ بهنام مولکول سال و ژن نگهبان شناخته شد بهطور طبیعی تقسیم میشود و رشد سلول را تحت نظر کامل دارد. روی این اصل موتاسیون ژن P53 در بیش از ۶۰ درصد بافتهای سرطانی دیده میشود. بیش از ۳۵ نوع ژنهای مهارکننده تا به امروز شناسایی و گزارش شدهاند. وظایف پروتئین P53 در حال طبیعی تنظیم تقسیم سلولها، خودکشی سلولها، مسن شدن سلولها، عروقسازی، تمایز یافتن سلولها و متابولیسم DNA است. بیش از ۲۶ هزار موتاسیون ژنتیکی در ژن p53 گزارش شده است. بیشتر این موتاسیونها در ناحیه DNA-binding اتفاق میافتد و درنتیجه ژنهای تحت کنترل p53 نمیتوانند نسخهبرداری کنند. همکاری پروتئین p53 با دو پروتئین CDK1-P2 و CDC2، سلولهای سرطانی را در مراحل G1 و G2 تقسیمسلولی نگه میدارد.
نبود ژنهای مهارکنندهی توموری باعث تقسیم غیرقابل کنترل سلولهای سرطانی میشود
پروتئین p53، هم مهارکننده و هم ارتقادهندهی سلولهای سرطانی است. پروتئین p53 پس از آسیب ژنهای دیگر به DNA متصل میشود و ژن WAF1 را فعال میکند. این ژن، پروتئین P21 را تولید میکند و به پروتئین CDK2 میچسبد و اجازهی ورود P21 به مرحلهی بعدی تقسیم سلولی را نمیدهد. پروتئین p53 یک ترکیبی از شبکهی حوادث مولکولی است که در تولید سلولهای سرطانی نقش مهمی را بازی میکند. پروتئین p53 فعال از طرف ترمینال N از دو طریق، فسفوریلاسیون میشود. ازطریق MAPK پروتئین و ازطریق ATM ،ATR و LHK پروتئین. وقتی که p53 فسفوریلاسیون میشود خاصیت چسبیدن به MDM2 را از دست میدهد. پروتئین pint شکل ساختمان p53 را تغییر میدهد و به عدم اتصال p53 به MDM2 کمک میکند. وقتی که ژن p53 فاقد ضربات محیطی است، مقدار p53 پائین میرود. پروتئین MDM2 به p53 میچسبد و از عملش جلوگیری میکند و آنرا به سیتوپلاسم سلول انتقال میدهد. عمل ضدسرطان p53 از سه مسیر انجامپذیر است:
- پروتئین p53 باعث تحریک پروتئینهای ترمیمکنندهی DNAr میشوند که به آسیبهای وارد شده به ژنها رسیدگی شود.
- پروتئین p53 باعث تحریک مرگ برنامهریزیشده میشود (وقتی که سلولهای آسیبدیده غیرقابل بازسازی باشند).
- پروتئین p53 تقسیم سلولی را در مرحله G1/S نگه میدارد تا فرصتی برای تعمیر باشد.
تشخیص سرطان
در صورتی که غدهای در پستان خود لمس کردهاید، اولین قدم در تشخیص، معاینه توسط پزشک جراح است. او به شما خواهد گفت که آیا چنین تودهای واقعا وجود دارد یا خیر و اگر وجود دارد، بیشتر احتمال دارد که این توده خوشخیم باشد یا سرطانی. پس از معاینه، پزشک ممکن است مراحل تشخیصی بعدی را برای شما درخواست کند. هرگز روشهای تشخیصی را بدون نظر پزشک و بهطور خودسرانه انجام ندهید. ممکن است در مواردی لازم باشد آن آزمایش به شکل دیگری انجام شود.
روشهای تصویربرداری متعددی وجود دارند که پزشک بهوسیلهی آن میتواند پستان را بررسی و در مورد تودهی احتمالی موجود در آن قضاوت کند. مهمترین این روشها که به فراوانی استفاده میشوند، ماموگرافی و سونوگرافی و در مرحلهی بعدی MRI هستند. آزمایش خون نیز گاهی اوقات منجر به شناسایی سرطان میشود. دیگر آزمایشها مثل اسکن استخوانی و بسیاری دیگر نیز شاید به قصدی دیگر انجام شوند، اما در نهایت اگر مشکلی وجود داشته باشد میتوانند کمککننده باشند.
روشهای درمان سرطان

۱. جراحی
جراحی یک روش سریع برای حذف تومورهای سرطانی از داخل بدن بیمار است. این روش برای تورموهایی به کار میرود که گسترش پیدا نکردند یا در اصطلاح پزشکی، متاستاز ندادهاند. جراحی یک روش تضمین شده برای حذف سلولهای سرطانی نیست و در صورت لزوم، پزشکان بخشهایی از لنف سالم را هم برمیدارند تا از عدم سرایت سرطان مطمئن شوند. گاهی به جای جراحی از پرتوهای لیزر استفاده میکنند یعنی با استفاده از پرتوهای قوی لیزر، تورمور سرطانی را میسوزانند که در سرطانهایی مانند رحم و پوست پرکاربردتر است.
۲. پرتو درمانی
در پرتودرمانی از پرتوهای پرانرژی برای از بین بردن سلولهای سرطانی استفاده میشود. پزشکان انواع مختلفی از روشهای پرتودرمانی و در برخی موارد ترکیبی از این روشها را بهکار میبرند.
- پرتودرمانی خارجی: در این روش تشعشعها از دستگاه بزرگی میتابد که در خارج از بدن قرار دارد. بیشتر افرادی که از این روش درمان استفاده میکنند باید به مدت چند هفته، هفتهای ۵ روز، برای درمان به بیمارستان یا کلینیک مراجعه کنند.
- پرتودرمانی داخلی: در این روش منشا تشعشعها، مواد رادیواکتیوی است که درون محفظههای ریز، سوزنها یا لولههای نازک پلاستیکی قرار داده شدهاند و داخل بافت یا اطراف آن کار گذاشته میشوند. معمولا بیمار طی درمان در بیمارستان، بستری میشود. محفظه رادیواکتیو اغلب چند روز در بدن بیمار باقی میماند.مقالهی مرتبط:نیمی از بازماندگان سرطان اطفال، دچار اختلالات هورمونی خواهند شد
- پرتودرمانی تمام بدن: در این روش منشا تشعشعها مایع یا کپسولی حاوی مواد رادیواکتیو است که به تمام قسمتهای بدن میرسد. بیمار این مایع یا کپسول را میبلعد یا به وی تزریق میشود. از اینگونه پرتودرمانی جز برای درمان سرطان، برای مهار درد شدید ناشی از سرطان پیشرفته نیز استفاده میشود. امروزه بعضی از سرطانها را به این شیوه درمان میکنند.
۳. شیمی درمانی
بهعنوان بخشی از فرآیندهای طبیعی بدن، سلولها بهصورت مداوم از راه تقسیم شدن، جایگزین میشوند. داروهای شیمی درمانی در توانایی تقسیم شدن سلول سرطانی مداخله میکنند. در این راستا ممکن است فقط از یک دارو یا ترکیبی از چند دارو استفاده شود. این داروها ممکن است به صورت مستقیم وارد جریان خون بشوند و به سلولهای سرطانی سرتاسر بدن حمله کنند؛ یا به صورت اختصاصی فقط قسمتهای سرطانی را هدف قرار دهند. عوارض جانبی این روش درمانی به نوع دارو و میزان مصرف آن بستگی دارد. این داروها بر سلولهای سرطانی و دیگر سلولهایی که به سرعت تقسیم میشوند تأثیر میگذارد و ممکن است عوارض زیر را داشته باشند:
- سلولهای خونی: هنگامیکه دارو به سلولهای خونی سالم آسیب برساند، خطر عفونت، کبودی یا خونریزی بیشتر میشود و بیمار احتمالاً احساس ضعف و خستگی شدید خواهد کرد.
- سلولهای ریشهی مو: شیمیدرمانی ممکن است موجب ریزش مو شود بااینحال موهای بیمار دوباره رشد خواهند کرد اما اغلب رنگ و جنسشان با موهای قبل متفاوت است.
- سلولهای پوشاننده دستگاه گوارش: شیمیدرمانی ممکن است باعث کماشتهایی، حالت تهوع، استفراغ، اسهال یا دردهایی در دهان و لبها شود. برخی از این داروها بر باروری تأثیر میگذارند. بانوان ممکن است دیگر نتوانند بچهدار شوند و مردان هم شاید قدرت باروری خود را از دست بدهند. با وجود اینکه عوارض جانبی شیمیدرمانی گاه دردناک و نگرانکننده است اما معمولا موقتی است و پزشک میتواند آنها را درمان یا مهار کند.
۴. ایمونوتراپی
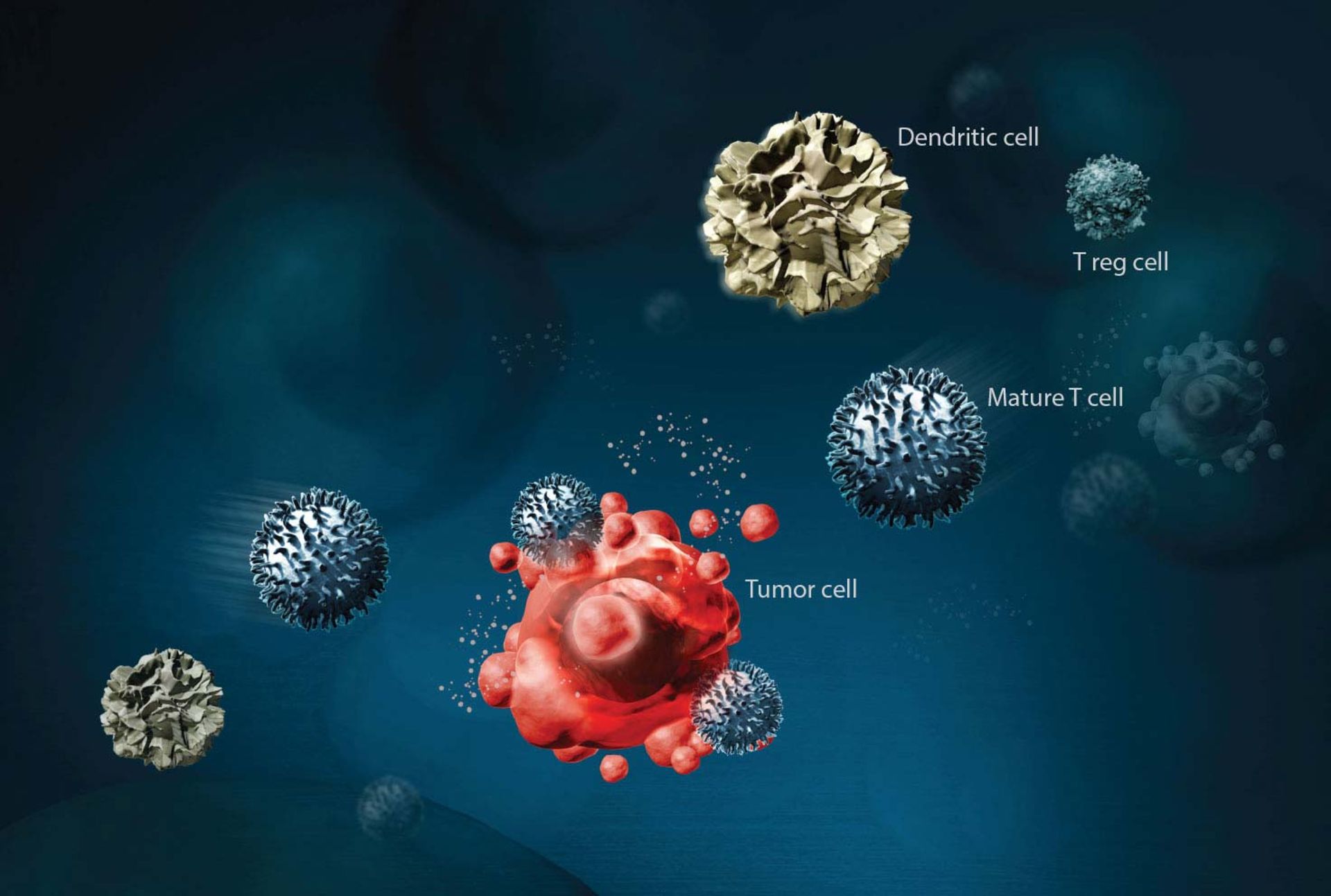
ایمونوتراپی درمانی است که از قسمتهای مشخص دستگاه ایمنی فرد برای مبارزه با بیماریهایی مانند سرطان استفاده میکند. روش کار به این شکل است که سلولهای T را از بدن بیمار خارج میکنند. سلولهای T نوعی گلبولسفید هستند که مهمترین ابزار بدن برای مبارزه با بیماریهای عفونی و سرطان محسوب میشوند. بعد از خارج کردن این سلولها، مهندسان ژنتیک وارد کار میشوند و با تغییری در سلولهای T و اضافه کردن آنتیژن مصنوعی، این سلولها را مجهز به راداری میکنند تا قدرت پیدا کردن سلولهای سرطانی را داشته باشد. سلولهای سرطانی حاوی نوع خاصی پروتئین هستند که این رادار قدرت شناسایی آن را دارد. گلبولهای سفید مجهزشده، دوباره وارد بدن میشوند تا به جنگ سلولهای سرطانی بروند. ایمنیدرمانی به چند صورت انجام میپذیرد:
در ایمونوتراپی به سلولهای T فرد بیمار، آنتیژن مصنوعی اضافه میشود
- تحریک سیستم ایمنی شما برای عملکرد بهتر یا هوشمندانهتر برای حمله به سلولهای سرطانی
- دادن ترکیباتی مانند پروتئینهای دستساز دستگاه ایمنی به بدنتان
بعضی انواع ایمونوتراپی، بیولوژیکتراپی یا بیوتراپی نامیده میشود. ایمونوتراپی شامل درمانهایی است که به روشهای مختلف عمل میکنند. تعدادی به سیستم ایمنی بدن در مسیری عمومی کمک میکنند. بقیه اختصاصا به سیستم ایمنی برای حمله به سلولهای سرطانی، کمک میکنند. ایمونوتراپی برای تعدادی از سرطانها کارآمدتر است ولی بنظر میرسد برای بقیه سرطانها وقتی با دیگر روشهای درمانی تلفیق شود کارآمدتر خواهد بود. انواع اصلی ایمونوتراپی که اکنون برای درمان سرطان استفاده میشود عبارتاند از:
- پادتنهای مونوکلونال: اینها ورژن دستساز پروتئینهای دستگاه ایمنی هستند. پادتنها میتوانند در درمان سرطان بسیار مفید باشند. آنها میتوانند طوری طراحی شوند که به قسمتهای مشخصی از سلول سرطانی حمله کنند.
- مهارکنندههای نقاط بازرسی ایمنی: این داروها اساسا ترمز دستگاه ایمنی را میگیرند که به شناسایی و حمله به سلولهای سرطانی کمک میکند.
- واکسنهای سرطان: واکسنها موادی هستند که به بدن تزریق میشوند تا پاسخ سیستم ایمنی را دربرابر بیماریهای مشخص موجب شوند. ما اغلب فکر میکنیم واکسنها به افراد سالم تزریق میشوند تا به جلوگیری از عفونتها کمک کنند. ولی تعدادی از واکسنها میتوانند به درمان و جلوگیری از سرطان کمک کنند.
- ایمونوتراپیهای غیر اختصاصی: این درمانها سیستم ایمنی را در یک مسیر کلی تقویت میکنند ولی این درمان به سیستم ایمنی برای حمله به سلولهای سرطانی کمک میکند.
۵. ژن درمانی
اگرچه در ابتدا از ژندرمانی بهعنوان روشی برای درمان سرطان یاد نمیشد، اما در واقع با فرایند مورد بحث میتوان تحولی در این حوزه ایجاد کرد. پزشکان و پژوهشگران از مهندسی ژنتیک برای برنامهریزی مجدد سلولهای ایمنی لنفوسیت T، بهمنظور درمان انواع خاصی از سرطان استفاده میکنند. این شیوهی درمانی به سرعت جایگاه خود را در دنیای پزشکی پیدا کرده است، اما در کنار عملکرد قوی، خطرات زیادی را نیز به همراه دارد. البته روشهای نوین ویرایش ژن میتوانند تا حد زیادی این خطر را کاهش دهند. طی سال ۲۰۱۶ تیمی از پژوهشگران آمریکایی تصمیم گرفتند از روش CRISPR برای تقویت سلولهای لنفوسیت T و درمان سرطان استفاده کنند. بعدا مشخص شد «شان پارکر» میلیاردر و کارآفرین عرصهی تکنولوژی سرمایهی مورد نیاز این پژوهش را تأمین میکند. ژنها که روی کرموزومها قرار دارند، واحدهای فیزیکی و کارکردی پایهای بدن هستند.
با جهشهای ژنتیکی مخرب، پروتئینها علملکرد طبیعی خود را از دست میدهند و باعث ایجاد بیماری ژنتیکی میشوند
ژنها توالیهای اختصاصی بازهایی هستند که چگونگی ساخت پروتئینها را رمزبندی میکنند. گرچه ژنها بیشتر مورد توجه قرار میگیرند، اما این پروتئینها هستند که اغلب کارکردهای حیاتی را انجام میدهند و حتی اکثریت ساختارهای سلولی را تشکیل میدهند. هنگامی که ژنها به نحوی تغییر پیدا کنند که پروتئینهای رمزبندیشده به وسیلهی آنها نتوانند کارکردهای طبیعیشان را انجام دهند، بیماریهای ژنتیکی بهوجود میآیند. ژندرمانی تکنیکی است برای تصحیح ژنهای معیوبی که مسئول ایجاد بیماری هستند. پژوهشگران ممکن است یکی از چندین رویکرد موجود را برای تصحیح ژنهای معیوب به کار ببندند. ژن طبیعی ممکن است به درون یک محل غیراختصاصی درون ژنوم کاشته شود تا یک ژن بیکارکرد را جایگزین کند؛ این روش یک رویکرد رایج است. یک رویکرد دیگر تعویض ژن غیرطبیعی ازطریق بازترکیبی هومولوگ است. ژن غیرطبیعی را میتوان ازطریق جهش معکوس انتخابی ترمیم کرد، که باعث میشود، ژن به کارکرد طبیعیاش بازگردد. تنظیم یک ژن خاص (میزانی را که یک ژن خاموش و روشن میشود) را نیز میتوان تغییر داد.
۶. هورمون درمانی
این روش که درمان غدد درونریز هم نامیده میشود سرطانیهایی که از هورمون استفاده میکنند را هدف قرار میدهند و به دو صورت عمل میکنند: از تولید هورمون در بدن جلوگیری میکنند یا شیوه عملکرد هورمون را تغییر میدهند. گاهی اوقات لازم است عضوهای هورمونساز مانند تخمدان و بیضه را خارج کنید.
پزشکان این روش را کنار درمانهای دیگر استفاده میکنند تا پیش از جراحی یا درمان تومورها کوچک شوند یا سلولهای سرطانی که به نقاط دیگر بدن گسترش یافتهاند را از بین ببرند. این روش احتمال بازگشت سرطان را کاهش میدهد. رشد بعضی سرطانها بستگی به ترشح نوعی هورمون در بدن دارد مثل سرطان سینه در خانمها. درمورد چنین سرطانهایی از هورمون درمانی استفاده میشود که در واقع از ترشح هورمونی که باعث رشد سرطان میشود، جلوگیری میکند. مثلا برای زنان مبتلا به سرطان سینه داروهای ضداستروژنی تجویز میشود.
۷. سلول درمانی
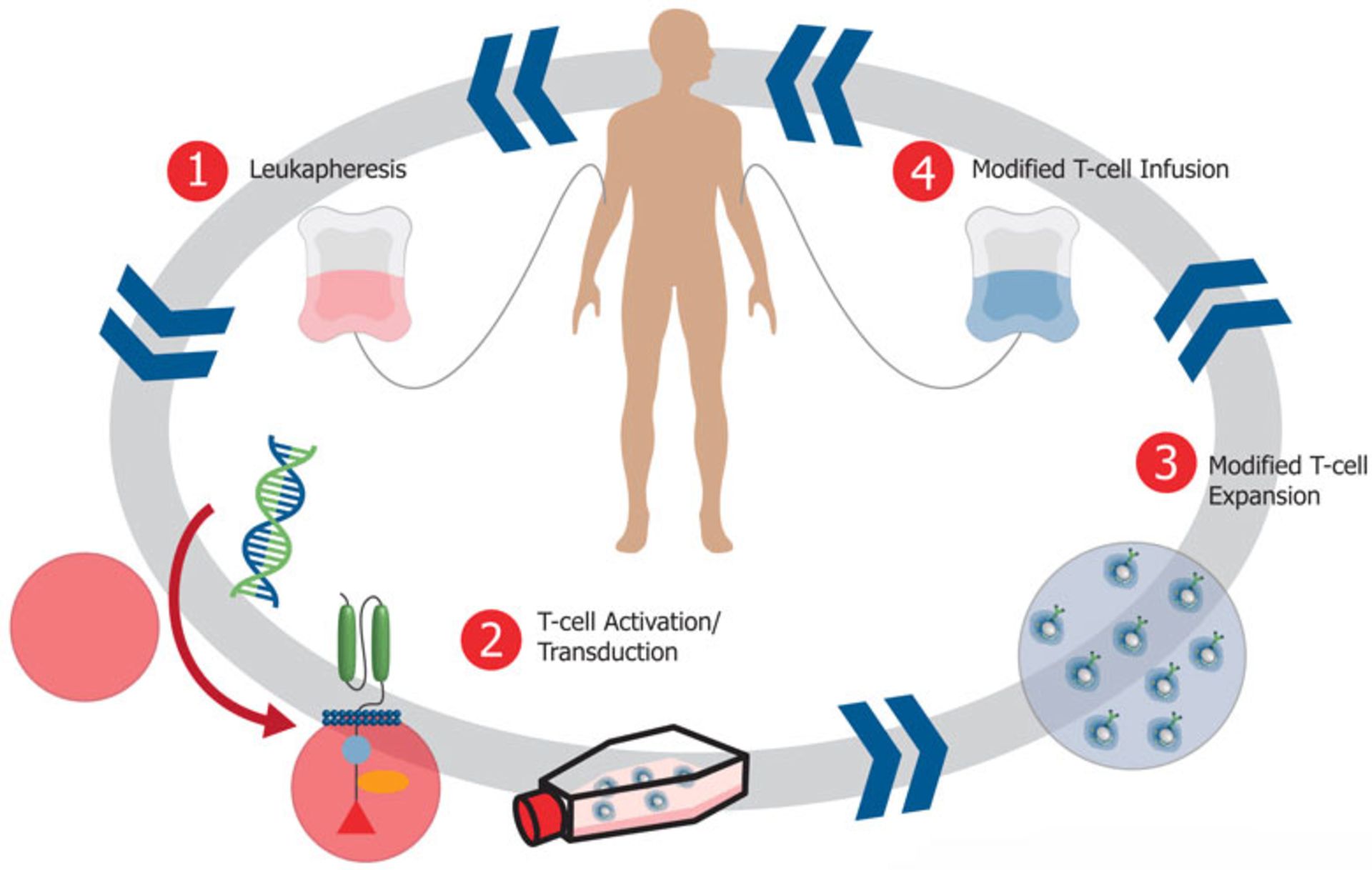
سلول درمانی که درمان سلولی یا سیتوتراپی (cell therapy) به پیوند سلول زنده از خود فرد یا فرد سالم دیگر با هدف بازسازی بافت بدن، گفته میشود. برای نمونه سلولهای T که قادرند ازطریق ایمنی سلولی (cell-mediated immunity) با سلولهای سرطانی مبارزه کنند، میتوانند بهمنظور ایجاد ایمنی در دورهی درمان، به بیمار تزریق شوند. کشف و معرفی سلولهای بنیادی و همچنین سلولهای پیشساز بهخصوص سلولهای بنیادی خونساز این روش را تبدیل به یک روش درمانی مؤثر در درمان بسیاری از سرطانها و نارساییهای تولید سلولهای خونی در مغز استخوان کرده است. سلولهای بنیادی مادر همه سلولهاست و توانایی تبدیل به همه سلولهای بدن را نیز دارد.
در سلتراپی، سلولهای سالم از خود فرد یا فرد سالم دیگر برای هدف بافتسازی پیوند زده میشود
این سلولها دارای توانایی خودنوسازی و تمایز به انواع سلولها مثل سلولهای خونی، قلبی، عصبی و غضروفی هستند. سلولدرمانی به پیوند سلول زنده از خود فرد یا فرد سالم دیگر با هدف بازسازی بافت بدن گفته میشود. سلولها کارخانههای قدرتمندی هستند که میتوانند اثرات درمانی را ازطریق روشهای متعددی اعمال کنند. سلولها میتوانند در محل آسیب لانهگزینی کنند، مواد محرک رشد ترشح کنند و در برخی موارد به سلولهای دیگری تبدیل شوند. این تطبیقپذیری باعث میشود سلول درمانی بهطور قدرتمندی عمل کند و امکان بالایی برای درمان بیماریهای غیرقابل برگشت فراهم کند. امروزه دو دستهی مختلف از سلولدرمانی شناخته شده است:
- اولین دسته از سلول درمانی که پایهگذاری شد، سلول درمانی در پزشکی اصلی (mainstream medicine) است که در آن سلولهای انسانی از یک دهنده به بیمار پیوند زده میشوند. پژوهشهای گستردهای در این روش در حال انجام است. چنین پژوهشهایی زمانی که روی جنین انسان انجام شود ممکن است بحثبرانگیز باشد.
- دسته دیگر، سلول درمانی در پزشکی جایگزین (alternative medicine) است که در آن از تزریق پیوستهی سلولهای جانوری با هدف درمان بیماریها استفاده میشود. انجمن سرطان آمریکا بیان کرده است که هیچ مدرک پزشکی اثربخشی این روش را حمایت نمیکند و این روش میتواند پیامدهای مرگباری داشته باشد.
۸. نانو درمانی
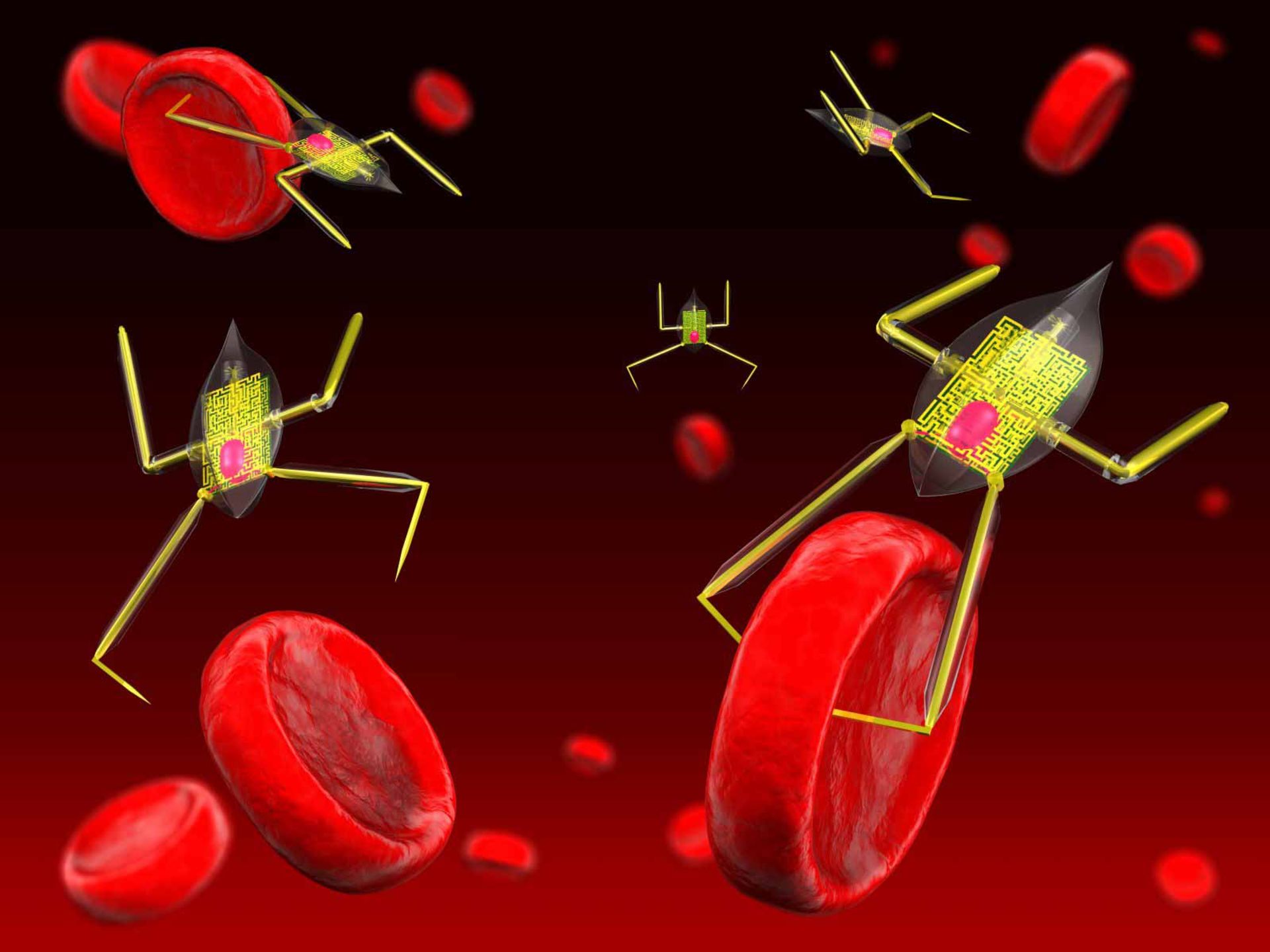
امروزه فناوری نانو به کمک تشخیص و درمان این بیماری آمده است طوری که سبب شده است تا سلولهای سرطانی در حد نانومتر تشخیص داده شوند و با کمک فناوری نانو از بین برده شوند. تشخیص سرطان در مراحل اولیه، در بهبود روشهای درمانی آن بسیار حائز اهمیت است، در حال حاضر تشخیص و شناسایی سرطان معمولا براساس تغییرات سلولها و بافتها صورت میگیرد که این کار با آزمایشهای بالینی پزشکی یا روشهای معمول عکسبرداری قابل انجام است. نانوذرات و نانوابزارها نقشی بینظیر و حیاتی را در تبدیل دانش به پیشرفتهای مفید بالینی در زمینه تشخیص و درمان سلولهای سرطانی ایفا میکنند، کاری که با انجام آن روند تشخیص و درمان و نهایتا پیشگیری از سرطان کاملاً متحول خواهد شد.
یکی از کاربردهای نانو ذرات، انجام همزمان دو عمل تشخیص تومور و رساندن دارو به تومور است
استفاده از این نانوذرات بهعنوان دارو و برای درمان سلولهای بدخیم سرطانی هیچگونه تأثیر بدی بر سلولها و بافتهای سالم بدن بر جای نمیگذارند. پس از رسیدن این نانوذرات به تومورها، داروهای درون آنها به وسیله نوارهای باریک نور لیزر فعال میشوند. این نانوذرات همچنین قادر به مشخص کردن میزان تأثیر درمان بر سلولهای بدخیم هستند. این ایده بزرگ که تنها با تزریق یک عامل بتوان تشخیص، درمان و گزارش در مورد میزان اثر بخشی درمان را انجام داد، امری است که فقط با کمک فناورینانو میسر میشود. یکی از امیدبخشترین کاربردهای نانو ذرات، میتواند بهکارگیری آنها به منظور انجام همزمان دو عمل تشخیص تومور و رساندن دارو به تومور باشد. نانوذراتی که در درمان سرطان به کار میروند عبارتاند از:
- نقاط کوانتومی: در افزایش حساسیت روشهای آزمایشگاهی تشخیص سرطان کاربرد دارند. همچنین مولکولهای درختسانها سبب تسهیل در دارورسانی میشوند. این مولکولها قابلیت بالایی در شناسایی و درمان بهطور همزمان دارند و در ضمن دارای سطح وسیعی هستند که بهوسیلهی آنها امکان اتصال عوامل درمانی یا سایر مولکولهای فعال زیستی فراهم میشود.
- نانو پوستهها: ساختاری با یک هستهی مرکزی است که غشای نازکی از یک فلز، مانند طلا روی آن روکش شده است و با استفاده از یک لیزر بیرونی و رساندن انرژی به نانوپوستهها در یک تومور امکان تخریب گرمایی یا عکسبرداری از آن مقدور است یا برای ترمیم زخم کاربرد دارد. این روش توسط پژوهشگران دانشگاه Rice در مدلهای حیوانی انجام شده است.
- نانو ذرات مغناطیسی: اکسید آهن جزو اصلی نانوذرات مغناطیسی است. مهمترین مزیت استفاده از این ذرات اندازهی کوچکتر از ۱۰۰ نانومتر آنها است. در واقع ذرات اکسید آهن Fe304 (مگنتیت) به دلیل سازگاری با سیستمهای بیولوژیک از اهمیت ویژهای برخوردار است.
با کمک میدان مغناطیسی میتوان این ذرات را به منطقه خاصی هدایت کرد که این امر باعث تسهیل در امر تصویربرداری برای تشخیص و همچنین درمان سرطان میشود. به دلیل این ویژگیها، نانو ذرات مغناطیسی کاربردهای پزشکی فراوانی را دارند. از دیگر کاربردهای نانو ذرات مغناطیسی، استفاده از آن برای انتقال DNA به داخل سلول، تصویربرداری MRI، درمان تودههای سرطانی به کمک حرارت درمانی، جداسازی مغناطیسی مواد و استفاده در مهندسی بافت است. با تجمع ذرات مغناطیسی در بافت سرطانی، تشخیص تومور با استفاده از MRI تا حد زیادی تسهیل میشود و علاوه بر این میتوان از این ذرات بهعنوان حامل داروهای ضد سرطان استفاده کرد.