۳۶ ژن جدید مرتبط با بیماری قلبی شناسایی شد

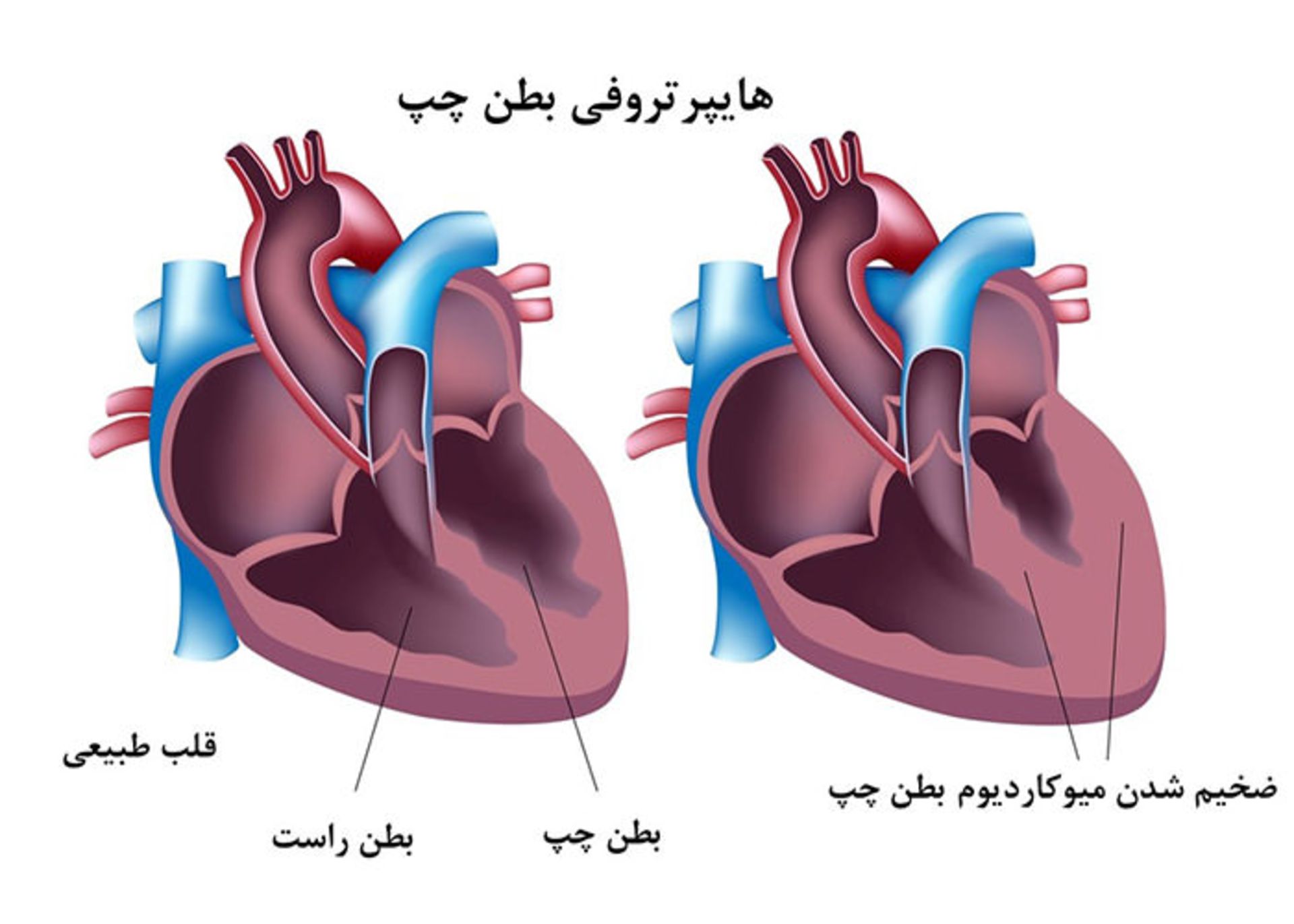
بر اساس اطلاعات مراکز کنترل و پیشگیری از بیماری آمریکا، ۲۵ درصد مرگومیر سالانه در این کشور بهعلت بیماریهای قلبی است. این بیماری قاتل اصلی مردان و زنان است؛ اما پیچیدگی ژنتیکی آن، درمان را دشوار کرده است. پروفسور الین کارما و همکارانش در ژورنال npj Systems Biology and Applications یافتههای خویش را در مورد ۳۶ ژن مرتبط با نارسایی قلبی منتشر کردند. یکی از این ژنها دارای نقش علیتی در هایپرتروفی قلب (ضخیم شدن غیر طبیعی ماهیچه قلب) است که میتواند منجر به نارسایی قلبی شود.
کارما میگوید:
این یک جهت هیجانانگیز برای طراحی داروهای شخصیشده و همچنین شناسایی ژنها و اهداف درمانی برای بیماریهای پیچیدهای است که ژنهای زیادی در آنها درگیر هستند.
هدف نهایی ایجاد داروهای شخصی برای درمان بیماریهای قلبی است. کارما گفت:
احتمالا هنوز یک دهه تا دستیابی به این نوع درمان فاصله وجود دارد؛ اما شرکتهایی که به توسعه چنین داروهایی علاقه مند هستند، میتوانند از روشی که من و همکارانم توسعه دادهایم و ژنهایی که شناسایی کردهایم، استفاده کنند تا یک قدم به این هدف نزدیکتر شوند.
مارک سانتولینی پژوهشگر این حوزه گفت که چارچوب توصیفشده در مقاله میتواند برای پیشبینی این که آیا افراد مبتلا به یک بیماری خاص به درمان دارویی پاسخ خواهند داد یا خیر، نیز مورد استفاده قرار گیرد. سانتولینی گفت:
در این روش می توان فقط با استفاده از یک آزمایش خون ساده پیشاپیش پیشبینی کرد که آیا برای یک بیمار باید داروی متفاوتی تجویز شود یا نه؛ این امر موجب صرفه جویی در زمان شده و روند درمان را سرعت میبخشد. بهطور کلی، این پژوهش اهمیت رویکردهای فردی را برای کشف ژنهای مرتبط با بیماری و افزایش آگاهی در زمینهی بیماریها نشان میدهد.
مفهوم شخصیسازی درمان (Personalized medicine) بر اساس اطلاعات ژنتیکی افراد بهصورت ساده در شکل زیر نشان داده شده است.
روش سنتی برای یافتن ژنهای مرتبط با بیماری قلبی به این صورت است: پژوهشگران قلبهای اهداشده را از افرادی که بهطور غیرمنتظره فوت کردهاند، اما قبل از آن سالم بودهاند، میگیرند، بیان ژن آنها را تجزیهوتحلیل میکنند (یعنی مقدار RNA پیامرسان و پروتئینها را اندازه گیری میکنند و مقادیر تولیدشده توسط ژنهای قلب سالم و ژنهای قلب بیمار را که از بیماران مبتلا به نارسایی قلب در آستانهی پیوند قلب، گرفته شده است، مقایسه میکنند). کارما میگوید:
شما یک الگوی بیان ژن متفاوت را میبینید. بهعنوان مثال، اگر بیان یک ژن در قلب بیمار دو برابر میزان بیان همان ژن در قلب سالم باشد، این ژن ممکن است مربوط به بیماری باشد. با این حال تاکنون این روش در یافتن ژنهای مهم چندان موفق نبوده است.
تیم او روش کاملا متفاوتی دارد؛ آنها از پنل هیبریدی تنوع موش یا Hybrid Mouse Diversity Panel استفاده میکنند؛ مجموعهای از صد سویه مختلف ژنتیکی موش که میتواند برای تجزیهوتحلیل عوامل ژنتیکی و محیطی مختلف مورد استفاده قرار گیرد. موشها درون هر سویه، به اندازهای همخون هستند که از لحاظ ژنتیکی معادل دو قلوهای همسان هستند.
این پنل (HMDP)، مجموعهای از حدود صد سویهی همخون بهخوبی شناختهشده از لحاظ ژنتیکی است که میتواند برای آنالیز عوامل محیطی و ژنتیکی پشت صحنهی صفات پیچیده، مورد استفاده قرار گیرد. این روش دارای مزایایی است؛ نخست ابنکه عوامل محیطی میتواند کنترل شود. دوم اینکه بافتهای مربوطه برای تعیین فنوتیپ ملکولی کلی در دسترس خواهد بود. همچنین سویههای همخون موش قابلیت تکرار دارند، نتایج حاصل از مطالعات جدا از هم، قابل تلفیق با هم است. تا کنون از HMDP برای مطالعهی صفاتی همچون چاقی، دیابت، تصلب شرایین، پوکی استخوان، نارسایی قلبی، تنظیم ایمنی، بیماری کبد چرب و اثرات متقابل میکروب و میزبان در دستگاه گوارش مورد استفاده قرار گرفته است.
پژوهشگران از هر سویه دو موش را برداشتند و به یکی از آنها یک داروی استرسور که موجب نارسایی قلبی میشد، دادند. سپس میزان بیان ژن موش در معرض استرس قرار گرفته را با موش همان سویه که استرس به او وارد نشده بود، مقایسه کردند. از آنجایی که هر دو موش ژنوم یکسانی داشتند، آنها قادر به شناسایی ژنهایی که بیان آنها در نتیجهی مستقیم استرس قلبی تغییر کرده بود، شدند. پژوهشگران از این طریق توانستند ۳۶ ژن را شناسایی کنند.
نقش بسیاری از این ژنها در نارسایی قلبی تاکنون ناشناخته مانده بود. کارما گفت که یکی از آنها عامل رونویسی است؛ به این مفهوم که بیان بسیاری از ژنهای دیگر را تحت کنترل دارد. پژوهشگران نقش آن ژن را با استفاده از تکنیکهای زیستشناسی مولکولی از طریق غیرفعال کردن آن و دیدن تغیرات حاصل در بیان ژن تایید کردند. آنها به این نتیجه رسیدند که ژن عامل رونویسی بهطور مستقیم با شبکهای از پروتئینهایی که در هایپرتروفی قلبی نقش دارند، ارتباط مستقیم داشت. گایدون کورن، پزشک و مدیر مرکز تحقیقات قلب و عروق بیمارستان رود آیلند و موسسه قلب و عروق گفت:
یکی از ژنهایی که کارما پیدا کرد، RFFL نامیده میشود و قبلا نیز پژوهشگرانی گزارش کرده بودند که با دیگر فرایندهای قلبی در ارتباط است. اگرچه تا کنون ارتباط آن با هایپرتروفی ناشناخته بود.
کورن در دو سال گذشته در آزمایشگاه خود ژن RFFL را مورد مطالعه قرار داده بود. کورن گفت:
این مطالعه نشان میدهد که این ژن برای صفت هایپرتروفی مهم است؛ RFFL یک گره مهم بین هایپرتروفی قلب و تحریک قلبی است.
تحریک قلبی فرآیندی است که به حفرههای قلب امکان انقباض و انبساط را میدهد.
کارما میگوید که مرحلهی بعد آزمون روش جدید روی سلولهای بنیادی انسان است. سلولهای بنیادی دارای همان اطلاعات ژنتیکی هستند که فرد از آنها حاصل شده است و میتواند الگوی بیان ژن مشابه با سلولهای قلبی داشته باشد. زمانی که شما دارید دو جمعیت سلولی از یک فرد را با هم مقایسه میکنید که یکی از آنها کنترلشده است و دیگری تحت اثر یک دارو یا استرسور قرار گرفته است، میتوانید تغییر در بیان ژن را بهصورت اختصاصی برای آن فرد مورد بررسی قرار دهید.