درمان دائمی ناشنوایی مادرزادی به کمک ژندرمانی
گروهی از پژوهشگران موفق شدند شنوایی را در موش مدل دارای ناشنوایی DFNB9 (یکی از رایجترین فرمهای ناشنوایی ژنتیکی مادرزادی) بازیابی کنند. افراد دارای ناشنوایی DFNB9، عمیقا ناشنوا هستند، زیرا آنها دارای کمبودی در ژن کدکنندهی اتوفرلین هستند؛ پروتئینی که برای انتقال اطلاعات صوتی در سیناپسهای سلولهای حسی شنوایی ضروری است. دانشمندان با تزریق داخل حلزونی این ژن در یک مدل موش بالغ DFNB9، بهطور موفقیتآمیزی عملکرد سیناپسی شنوایی و آستانههای شنوایی را به سطح نزدیک نرمال برگرداندند. این یافتهها مسیر جدیدی برای آزمایشهای ژندرمانی آینده در بیماران دارای DFNB9 خواهد گشود.
بیش از نیمی از نقایص شنوایی مادرزادی غیرسندرمی، دارای یک علت ژنتیکی بوده و حدود ۸۰ درصد از این موارد ناشی از فرمهای اتوزومی مغلوب (DFNB) هستند. در حال حاضر، کاشت حلزون تنها گزینهی درمانی بازیابی شنوایی در این بیماران است.
وکتورهای AVV، از امیدبخشترین وکتورها برای ژندرمانی بیماریهای انسانی محسوب میشوند. ژندرمانی مبتنی بر AAV، گزینهی درمانی امیدوارکنندهای برای درمان ناشنوایی است اما کاربرد آن توسط یک پنجرهی درمانی باریک محدود میشود. در انسانها، توسعهی گوش داخلی در داخل رحم کامل میشود و شنوایی تقریبا در هفتهی بیستم بارداری ممکن میشود. علاوهبراین، فرمهای ژنتیکی ناشنوایی مادرزادی در دورهی نوزادی تشخیص داده میشوند. بر این اساس، باید در رویکردهای ژندرمانی در مدلهای حیوانی این مسئله مدنظر قرار گیرد و کارایی ژندرمانی پس از توسعهی کامل سیستم شنوایی ارزیابی شود. بهعبارت دیگر، روش درمان باید ناشنوایی موجود را معکوس کند.
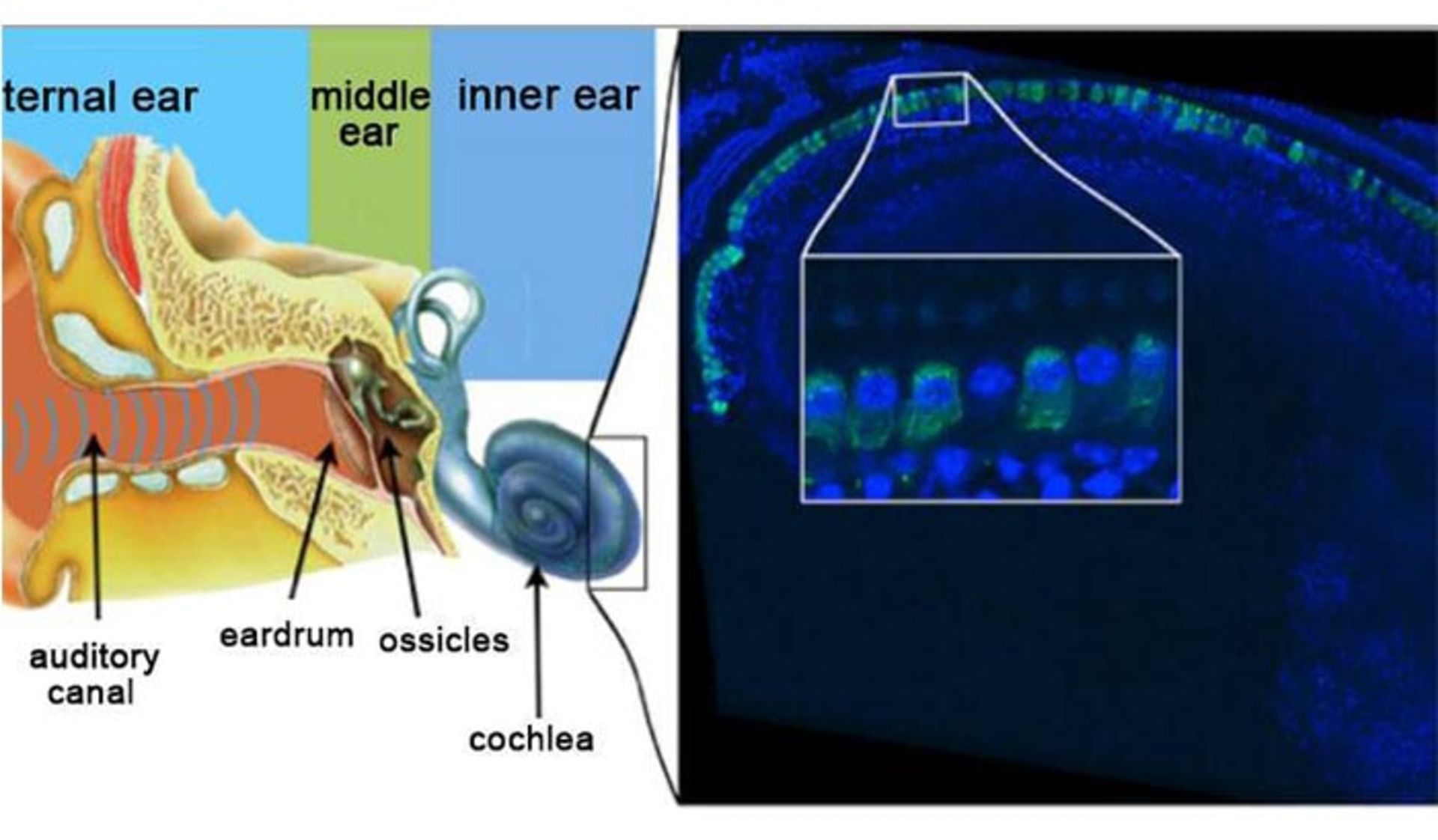
در تصویر بالا سمت چپ نمایشی از ساختار گوش انسان مشاهده میشود. امواج صوتی توسط گوش بیرونی که از لالهی گوش و مجرای شنوایی خارجی تشکیل شده است، جمعآوری میشوند. گوش میانی که از پردهی صماخ و استخوانچههای گوش تشکیل شده است، امواج صوتی را به گوش داخلی که دارای بخش حلزونی است، متتقل میکند. بخش حلزونی، ارگان شنوایی مسئول انتقال پیامهای شنوایی به سیستم عصبی مرکزی است. تصویر سمت راست، نشاندهندهی تصویر ایمونوفلورسانس از اپیتلیوم حسی شنوایی درون یک حلزون است که تحت ژندرمانی قرار گرفته است. سلولهای پوشش داخلی دارای اتوفرلین به رنگ سبز دیده میشوند. اتوفرلین تقریبا در تمام این سلولها قابل شناسایی است. قسمت بزرگشده از تصویر ناحیهای است که نشاندهندهی یک سلول مویی درونی است که ژنی به آن منتقل نشده است.
دانشمندان از یک مدل موش DFNB9 (فرمی از ناشنوایی انسانی که ۸-۲ درصد از کل موارد نقایص ناشنوایی مادرزادی را شامل میشود) استفاده کردند. ناشنوایی DFNB9 توسط جهشی در ژن کدکنندهی اتوفرلین ایجاد میشود، پروتئینی که نقشی کلیدی در انتقال اطلاعات صوتی در سیناپسهای سلولهای مویی داخلی دارد.
موشهای دارای جهش کمبود اتوفرلین عمیقا ناشنوا هستند زیرا با وجود نبود نقایص قابل تشخیص در اپیتلیال حسی، این سیناپسها نمیتوانند در پاسخ به تحریک صوتی ناقل عصبی آزاد کنند. بنابراین موشهای DFNB9 مدل مناسبی برای آزمایش کارآیی ژندرمانی ویروسی بهشمار میروند.
از آنجایی که وکتورهای AAV دارای محدودیت ظرفیت بستهبندی DNA هستند (حدود ۴/۷ کیلوباز)، استفاده از این تکنیک برای ژنهایی که منطقهی کدکنندهی آنها (cDNA) به بیش از ۵ کیلوباز میرسد، دشوار است. منطقهی کدکنندهی ژن اتوفرلین نیز طولی بهاندازهی ۶ کیلوباز دارد که خارج از این محدوه است. دانشمندان با ارائهی رویکردی بهنام راهبرد دوگانهی AAV، بر این محدودیت غلبه کردند. در این رویکرد از دو وکتور نوترکیب مختلف استفاده میشود که یکی حاوی انتهای ۵ پریم ملکول cDNA اتوفرلین است و دیگری انتهای ۳ پریم آن را شامل میشود. تزریق داخل حلزونی جفت وکتور در موش بالغ موجب ترکیب مجدد دو قطعه و بازسازی منطقهی کدکنندهی اتوفرلین شد. این امر درنهایت منجر به بازیابی طولانیمدت بیان اتوفرلین در سلولهای مویی داخلی و سپس بازیابی شنوایی شد.
دانشمندان تأیید اولیه را برای انتقال ویروسی cDNA تقسیمشده در حلزون گوش با استفاده از دو وکتور به دست آوردند. این امر نشان میدهد که میتوان از این رویکرد برای تولید اتوفرلین و اصلاح دائمی فنوتیپ ناشنوایی عمیق در موش استفاده کرد. این نتایج نشان میدهند که پنجرهی درمانی برای انتقال محلی ژن برای بیماران دارای ناشنوایی مادرزادی DFNB9 میتواند وسیعتر شود و امیدهایی را برای استفاده از این یافتهها برای درمان دیگر فرمهای ناشنوایی فراهم میکند.