چرا احساس درد بین دو جنس یکسان نیست

برای دههها فرض بر این بود که پردازش درد در دو جنس یکسان است؛ اما اکنون دانشمندان دریافتهاند که مسیرهای بیولوژیکی متفاوتی در ایجاد درد در دو جنس دخالت دارند. رابرت سورج در سال ۲۰۰۹ در حال مطالعهی درد در موشها بود اما نتایج غیرمنتظرهای دید.
سورج از دانشگاه مکگیل در مونترال کانادا درحال بررسی این موضوع بود که حیوانات چگونه دچار حساسیت شدیدی نسبتبه تماس میشوند. او برای آزمایش واکنش موشها، پنجههای آنها را با موهای نازکی قلقلک داد؛ کاری که بهطور معمول موجب آزار آنها نمیشود. موشهای نر دارای همان رفتاری بودند که مقالات علمی آن را پیشبینی میکرد؛ آنها حتی از نازکترین رشتهها نیز دوری میکردند. اما موشهای ماده نسبتبه این تحریک بیاعتنا بودند و واکنشی نشان نمیدادند. سورج و جفری موگیل گفتند: «ما نتوانستیم علت این امر را درک کنیم».
آنها پژوهشهای خود را ادامه دادند تا تعیین کنند آیا این نوع از حساسیت بیش از حد دربرابر درد، حاصل مسیرهای مختلف مرتبط با درد در موش نر و ماده است و انواع مختلفی از سلولهای ایمنی در این رنج مشارکت دارند یا خیر. اگر سورج و موگیل از روشهای معمولی پژوهشگران در زمینهی مطالعهی درد پیروی میکردند، هیچگاه به کشف خود نمیرسیدند. اما با مطالعهی مجزای موشهای نر و ماده در این پژوهش، آنها به سوی کشف موضوع جدیدی هدایت شدند. در آن زمان، بسیاری از پژوهشگران مطالعات مرتبط با درد از این موضوع نگران بودند که چرخهی هورمونی مادهها موجب پیچیدگی نتایج شود. بر این اساس، پژوهشگران به جنس نر روی آوردند زیرا در این جنس بهخوبی مشخص میشود که چه چیزی در حال اتفاق افتادن است.

امروزه پژوهشگران با الهام از پژوهش سورج و موگیل، طیف وسیعی از پاسخها را در دو جنس مورد بررسی قرار میدهند. نتایج این پژوهشها کمکم در حال پیدایش هستند. موردی که آشکار شده، این است که مسیرهای درد متغیر بوده و سلولهای ایمنی و هورمونها نقشهای کلیدی در تفاوت واکنشها دارند. این تلاش بخشی از یک جنبش گستردهتر برای درنظرگرفتن جنس بهعنوان یک متغیر مهم در پژوهشهای زیست پزشکی است. هدف، کسب اطمینان از این موضوع است که نتایج فقط مختص به جمعیت خاصی نباشند بلکه کل افراد جامعه را شامل شود.
در این زمینه، یک تغییر عمده در سال ۲۰۱۶ پیش آمد، وقتی که مؤسسهی ملی بهداشت آمریکا (NIH) پژوهشگران را ملزم به انتخاب جنس حیوانات آزمایشی خود کرد. کارا تاننبائوم از مؤسسهی جنسیت و سلامتی در مونترال میگوید:
کشفهایی که در زمینهی پژوهشهای مرتبط با درد حاصل شده، از هیجانانگیزترین موضوعات علمی درحال ظهور است. در هیچ حوزهی دیگری از علم چنین تفاوت جنسی شناسایی نشده است.
میکروگلیاها سلولهای ایمنی سیستم عصبی پشت صحنهی اشکالی از درد در موش نر هستند
این پژوهش میتواند مسیر جدیدی برای پیشرفتهای پزشکی جدید باز کند. این نوع پژوهشها یقینا مورد نیاز هستند: حدود ۲۰ درصد از مردم در سرتاسر جهان از درد مزمن رنج میبرند و بیشتر آنها را زنان تشکیل میدهند.
امروزه، داروهای ضد درد یکسانی برای همهی افراد تجویز میشود. اما اگر ریشههای درد متفاوت باشند، برخی داروها ممکن است در برخی از افراد نسبتبه افراد دیگر نتیجهی بهتری داشته باشد. علاوهبراین ممکن است وقتی که سطوح هورمونی افراد در طول زندگی دچار تغییر میشود، به داروهای ضد درد متفاوتی نیاز داشته باشند. جنسیت یک فرد همیشه آشکارا در طبقهبندیهای مجزای نر و ماده قرار نمیگیرد؛ این مسئله تحتتاثیر طیف وسیعی از خصوصیات نظیر ژنتیک، توسعهی آناتومیکی و سطوح هورمونی قرار میگیرد که هرکدام از آنها ممکن است روی نیاز یک فرد در درمانهای مرتبط با درد تأثیرگذار باشد.
این تصویر هنوز ناقص است و مطالعات (که بیشتر آنها روی جوندگان انجام شده است)، تاکنون روی جنسهای بیولوژیکی انجام شده؛ جنس (sex) لزوما معادل جنسیت (gender) نیست. ایان شسل، دانشمند علوم اعصاب پیشبینی میکند که داروهای ضد درد آینده بهطور اختصاصی برای افراد طراحی شوند و در آنها جنس یک عامل کلیدی تجویزهای شخصی باشد. او اضافه میکند: «ولی ما هنوز آن را درک نکردهایم».
ایمنی دربرابر درد
درد زمانی اتفاق میافتد که حسگرهای عصبی موجود در پوست، عضلات، مفاصل یا اندامهای دیگر وجود یک عامل مضر مانند حرارت یا آسیب بافتی را درک میکنند. آنها سیگنالهایی را ازطریق اعصاب محیطی به ستون فقرات میفرستند و از این بخش سیگنالهایی به جریان خون و روی قشر مغز ارسال میشود و موجب میشود ما احساس درد کنیم. اما درد از راههای زیادی اتفاق میافتد و مسیرهای شیمیایی متنوعی در آن مشارکت دارند. برخی از انواع درد براساس زمان تغییر میکنند.
واکنش حادی در پاسخ به عوامل داغ، تیز یا سمی وجود دارد و نیز یک درد مزمن طولانیمدتی که ممکن است حتی پس از بهبود جراحت اولیه برجای بماند. درد مزمن میتواند بهعنوان حساسیت بیش از اندازه به محرکهای غیردردناک بروز کند مانند همان مورد موشهای نر سورج. او و موگیل در سال ۲۰۰۹ در حال مطالعهی مدلی از درد مزمن بودند که آغازگر آن التهاب بود.
تزریق یک ملکول باکتریایی به نام لیپوپلیساکارید به داخل ستون فقرات موش موجب جلب توجه میکروگلیاها یعنی سلولهای ایمنی موجود در سیستم عصبی شد. اما در مطالعات سورج این امر تنها موجب بروز التهاب در نرها شد که توضیح میدهد چرا آنها انقدر دربرابر آزمایش تحریک با مو در مطالعهی سال ۲۰۱۱ حساس بودند. سلولهای میکروگلیا در مادهها خاموش ماندند که بهنظر میرسید علت بیتفاوتی آنها نسبتا به تحریک با مو باشد.
سورج و موگیل برای درک بهتر این موضوع که چرا موشهای نر و ماده در برخورد با درد چنین تفاوتی دارند، به منبعی از درد روی آوردند که تمام موشها را تحتتاثیر قرار میدهد. آنها به اعصاب سیاتیک این جانوران آسیب زدند؛ اعصابی که از بخش تحتانی کمر بهسوی پاها روانه میشوند. این کار منجر به بروز شکلی از درد مزمن میشد که زمانی اتفاق میافتد که سیستم تشخیص درد بدن آسیب میبیند یا دچار اختلال در عملکرد میشود. این کار موجب میشد که هر دو جنس موش بهشدت نسبتبه لمس کردن حساس شوند. حتی در این مورد هم تفاوتهایی وجود داشت. بهنظر میرسید که میکروگلیا دارای نقش برجستهای در درد در نرها باشد اما در مورد موشهای ماده چنین چیزی وجود نداشت. سورج و گروهی از همکارانشان دریافتند که بدون توجه به روش مهار میکروگلیا، این کار موجب حذف حساسیت بیش از حد به درد در نرها میشد. قضیه این نیست که مادهها نسبتبه درد ایمن بودند؛ آنها درست مانند موشهای نر بهوسیلهی آسیب عصبی دچار رنج میشدند اما برای حساس شدن بیش از حد دربرابر لمس از میکروگلیا استفاده نمیکردند.
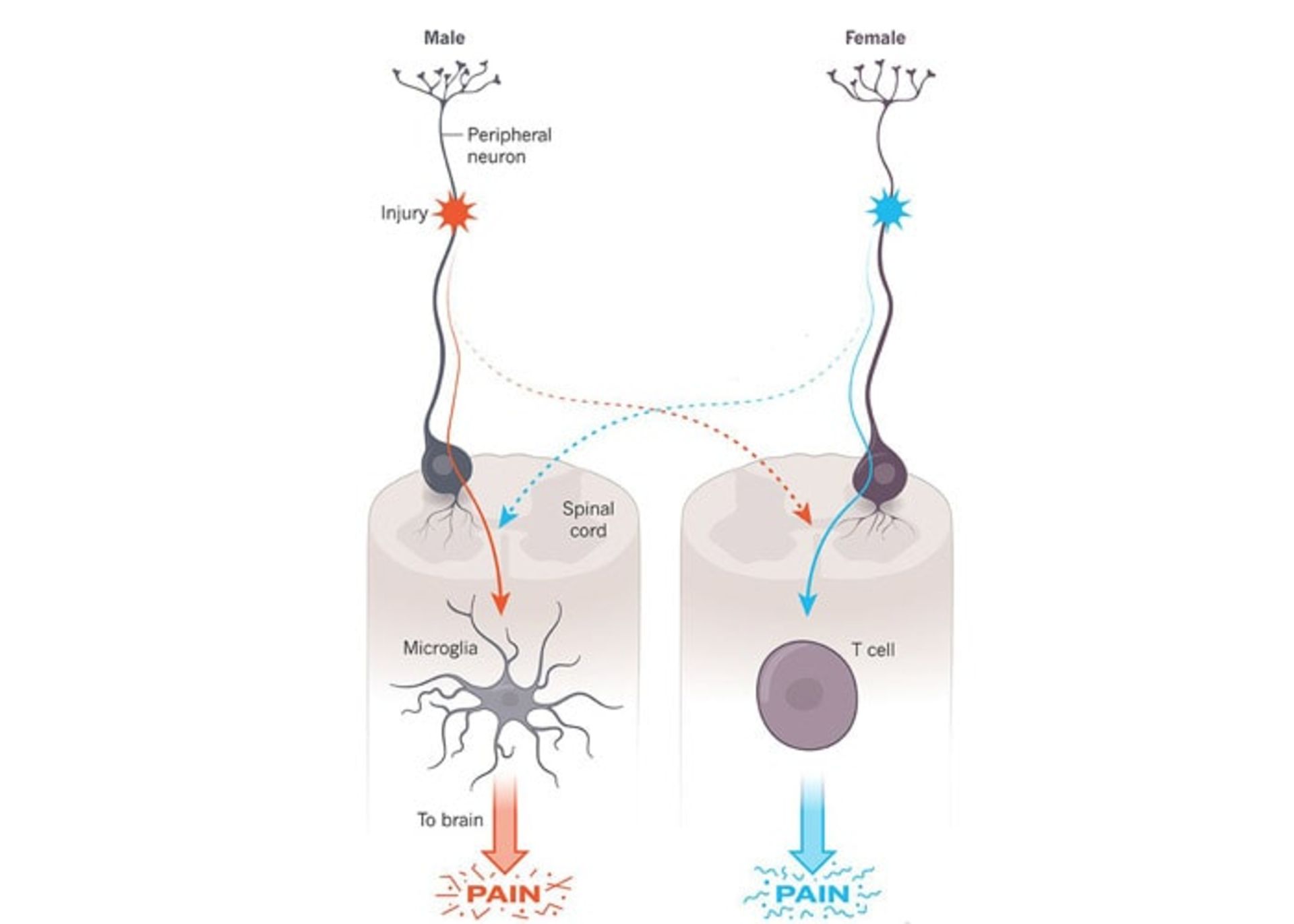
موگیل و سورج میخواستند بدانند که آیا پشتصحنهی درد مزمن در مادهها، یک مولفهی ایمنی دیگر به نام سلول T وجود دارد یا خیر. این سلولها در موشها دارای نقش شناختهشدهای در احساس درد هستند. سورج تلاش کرد که همان جراحت را در موشهای مادهی بدون سلولهای T ایجاد کند. آنها باز هم نسبتبه تحریک موها حساس بودند اما این بار بهنظر میرسید که این مکانیسم بهواسطهی میکروگلیا اتفاق افتد. اگر موشهای ماده فاقد سلولهای T بودند، مهار فعالیت میکروگلیا از این واکنش درد پیشگیری میکرد؛ درست بههمان شکلی که در نرها اتفاق میافتاد. زمانیکه پژوهشگران سلولهای T را به موشهای مادهای که فاقد این سلولها بودند، برگرداندند، این جانوران استفاده از میکروگلیاها را در درد ناشی از جراحت عصب متوقف کردند. گرگ داسور از دانشگاه تگزاس میگوید:
یافتههای این پژوهشگران که در سال ۲۰۱۵ گزارش شد، دارای تاثیر بزرگی بر حوزهی مطالعات درد بود. نتایج نشان دادند که حتی اگر درد بدن از بیرون مشابه بهنظر برسد، ولی دانشمندان نمیتوانند از درون آن را یکسان درنظر بگیرند.
نقاط درد
اگر مسیرهای پردازش درد در حیوانات دچار تغییر میشود، چه چیزی کنترلکنندهی این تغییر است؟ پژوهشگران مدتها است تفاوتهای جنسی در ادراک درد را به استروژن نسبت دادهاند؛ هورمونی که توسعهی رحم، تخمدان و سینه را در زنان کنترل میکند و نیز تنظیمکنندهی قاعدگی است. استروژن میتواند بسته به غلظت و موقعیت، درد را تشدید کند یا موجب فروکش شدن آن شود.
تستوسترون، هورمون درگیر در توسعهی آلت تناسلی نر، بیضهها و پروستات و نیز خصوصیات ثانویهای مانند موهای بدن است ولی پژوهشگران توجه کمتری به آن مبذول کرده کردند. اگرچه مطالعات نشان میدهند که این هورمون میتواند موجب کاهش درد شود و برخی از افراد مبتلا به درد مزمن، درمانهای تستوسترونی دریافت میکنند. در مورد میکروگلیاها و حساسیت به درد، پژوهش موگیل بهطور مستقیم به تستوسترون بهعنوان یک کلید کنترل برای مسیرهای درد اشاره میکند. در مطالعات سال ۲۰۱۱ و ۲۰۱۵، زمانیکه سورج موشهای نر اختهای را که دارای سطوح تستوسترون پایین بودند، مورد مطالعه قرار داد، مشاهده کرد که این جانوران واکنشی مشابه جانوران ماده نشان دادند. و زمانیکه پژوهشگران تستوسترون را به موشهای نر اخته یا به مادهها تزریق کردند، مسیر درد آنها به مسیر وابسته به میکروگلیا تغییر یافت. از آن زمان، پژوهشگران برای یافتن شواهدی برای نشان دادن اهمیت میکروگلیاها در موشهای نری که درد را تجربه میکنند، مطالعاتی انجام دادند.
این پدیده محدود به موش نیست: میشل سلتر دانشمند علوم اعصاب و همکار موگیل دریافت که گیرندههای میکروگلیا در موشهای صحرایی نرِ دارای حساسیت بیش از حد به آسیب عصبی نقش دارند. سلتر هماکنون درحال بررسی این موضوع در میمونهای ماکاک است، موجودی که احتمالا مسیر پردازش درد در آن مشابه انسان است. مطالعهی مسیر درد در انسانها بسیار دشوارتر است اما سرنخهایی درحال ظهور است. تد پرایس و همکارانش درمورد اختلاف نحوهی مشارکت سلولهای ایمنی در درد در انسانها شواهد اولیهای را پیدا کردهاند. مطالعهی آنها همین ماه منتشر شده است.
این دانشمندان در حال انجام پژوهش روی بافت عصبی جداشده از افراد مبتلا به سرطان هستند که تومورهای آنها به ستون فقراتشان حمله کرده است. آنها در اعصاب برداشتهشده از مردانی که درد را تجربه میکردند، علایمی از التهابی را که بهوسیلهی یک سلول ایمنی به نام ماکروفاژ ایجاد شده بود، پیدا کردند. این سلولها دارای عملکردی شبیه میکروگلیا هستند؛ اگرچه بهنظر میرسید در زنانی که دچار درد بودند، خود سلولهای عصبی نقش اصلی را برعهده دارند.
این نتایج نشاندهندهی تشابه بین اختلافهای جنسی مرتبط با درد در انسانها و جوندگان است. اما سلولهای ایمنی و هورمونها کاملا اختلافهای مرتبط با درد را تشریح نمیکنند. برای مثال، سارا لینستائید از دانشگاه کارولینای شمالی شواهدی پیدا کرده که نشان میدهد برخی از زنان ممکن است دارای استعداد ژنتیک نسبت به درد مزمن باشند. گروه او مجموعهای از ملکولهای RNA را پیدا کردهاند که احتمال وجود آنها در جریان خون زنانی که پس از تصادف با یک وسیلهی نقلیهی موتوری دچار درد مزمن در ناحیهی گردن، شانه یا کمر میشدند، بیشتر بود. بسیاری از این ملکولهای RNA به وسیلهی ژنهایی که روی کروموزوم X قرار گرفتهاند، کدگذاری میشوند و دو نسخه از آنها در بیشتر این زنان دیده میشد. لینستاندت میگوید:
این یافتهها، اطلاعات خوبی هستند که ما را قادر خواهند ساخت تا درمانهای جدیدی توسعه دهیم که بتوانند بهطور خاص در زنان یا در دوزهای بالاتر در زنان استفاده شوند.
تفاوتهای دارویی
پژوهشگران دیگر نیز در مورد درمانهای ضد درد خاص جنسی فکر میکنند. در مطالعهای که در نوامبر سال ۲۰۱۸ منتشر شد، پرایس و همکارانش گزارش کردند که یک داروی دیابت به نام متفورمین موجب کاهش جمعیتهای میکروگلیا اطراف نورونهای حسی در نخاع میشود. آنها همچنین نشان دادند که این دارو حساسیت نسبت به درد مرتبط با آسیب عصبی را تنها در موشهای نر مهار میکند. پرایس میگوید:
این دارو در مادهها تاثیری نداشت؛ درواقع آنها حتی کمی بدتر شدند.
متفورمین برای ورود به سیستم عصبی متکی به پروتئینی است که در سطوح بالاتری در سلولهای افراد نر بیان میشود. دوزهای بالاتر دارو موجب ایجاد تفاوتی در مادهها نشد که احتمالا به خاطر این است که این دارو خارج از اعصاب به دام میافتاد. دوزهای بالاتر به مادهها کمک میکرد که آنها یکی از قدیمیترین داروهای مرتبط با درد یعنی مورفین را دریافت کنند. زنان و نیز مادههای جوندگان هر دو معمولا نیاز به دوزهای بالاتری از مورفین دارند تا به همان اندازهی جنس نر دردشان تسکین یابد.
آن مورفی یکی از معدود دانشمندانی بود که قبل از اینکه NIH دستورالعملهای خود را تغییر دهد، درحال مطالعهی اختلافهای جنسی در زمینهی درد بود. گروه مورفی در سال ۲۰۱۷ گزارش کردند که میکروگلیا نیز در اختلاف جنسی در تاثیرات مورفین نقش دارد. این دارو با مهار نورونها در منطقهای از مغز که مادهی خاکستری اطراف مجرا یا PAG نامیده میشود، موجب تسکین درد میشود. اما این دارو همچنین میتواند موجب فعال شدن میکروگلیا در این منطقه از مغز شود و موجب خنثی شدن تاثیرات مسکن مورفین شود. این دقیقا همان چیزی است که در موشهای صحرایی ماده اتفاق میافتد. موشهای صحرایی ماده نسبتبه نرها میکروگلیاهای فعال بیشتری در PAG دارند.
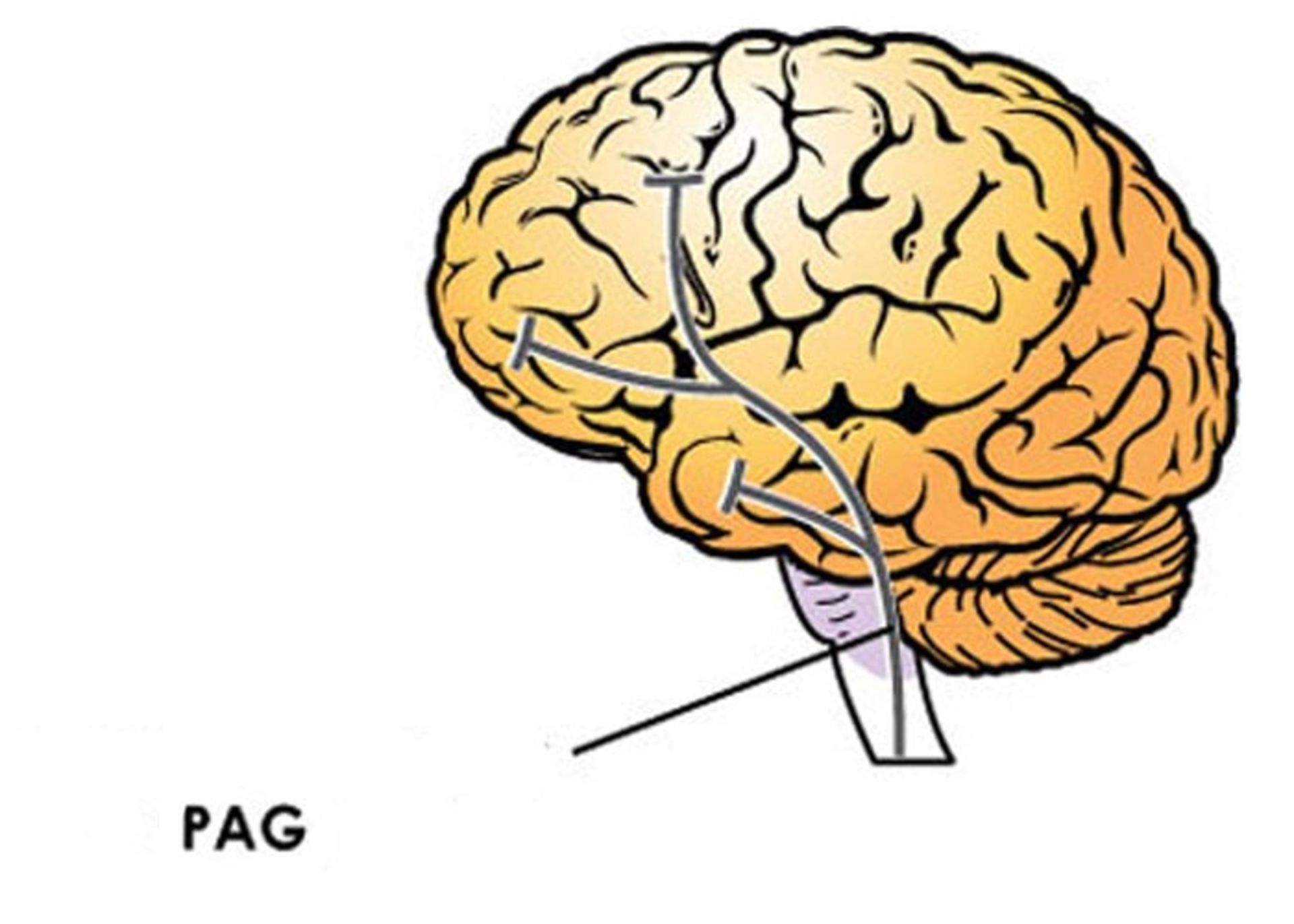
وقتی که این موشها قبل از اینکه دانشمندان یک پرتو نور داغ را به پنجههای آنها بتابانند، با استفاده از مورفین تحت درمان قرار میگرفتند، جانوران ماده التهاب بیشتری در PAG داشتند و پاهای خود را سریعتر از نرهایی که همان دوز از دارو را دریافت کرده بودند، عقب میکشیدند. زمانیکه گروه مورفی، اثرات مورفین را روی میکروگلیاها مهار کردند، نرها و مادهها واکنش مشابهی در زمینهی درد نشان دادند.
حداقل یک دارو در بازار وجود دارد که دانشمندان فکر میکنند شاید در دو جنس عملکرد متفاوتی داشته باشد. در سال ۲۰۱۸، سازمان غذا و داروی آمریکا برای میگرن، درمانهای مبتنی بر آنتیبادیهایی علیه CGRP (پپتیدی که در سیستم عصبی یافت میشود و این نوع از سردردها نقش دارد) را توسعه دادند. شیوع میگرن در زنان سه برابر مردان است.
گروهی از پژوهشگران تحت هدایت پرایس و داسور، در مطالعهای که هنوز منتشر نشده است، CGRP را به غشای ضخیم اطرف مغز وارد کردند. این پپتید در مادهها موجب بروز پاسخی شد که بهنظر میرسید شبیه میگرن باشد: چهرهی این جانوران در هم رفت و صورت آنها نسبت به لمس کردن، حساس شد. داسور میگوید:
در نرها: هیچچیز. شاید داروهای مدرن ضد CGRP در زنان نسبتبه مردان نتیجهی بهتری داشته باشد اما این نوع از اثرات دارو در آزمایشهای بالینی مورد بررسی قرار نگرفته است.
این، وضعیت معمول بسیاری از آزمایشهای دارویی است. آنها معمولا شامل زنان و مردان میشوند اما تعداد هر کدام از این گروهها معمولا چنان زیاد نیست که بتوان چنین تفاوتهایی را تشخیص داد. پرایس میگوید:
احتمال داشت اثربخشی داروهای ضد دردی که در آزمایشهای بالینی پیشین با شکست روبهرو شدهاند، درصورتیکه بهصورت جداگانه روی دو جنس آزمایش میشدند، تأیید میشد. این امر بهنظر آشکار میآید ولی کسی واقعا درصدد انجام آن بر نمیآمد.
قرصهای شخصی
شسل علاقمند به توسعهی یک داروی ضد درد است که فقط روی افراد یک جنس اثر داشته باشد. اما جنس شرکتکنندگان در مطالعه و جانوران تحت آزمایش بهوسیلهی قوانین دولتی، نگرانیهای اخلاقی و نیز قابلیت انجام این آزمایشها تعیین میشود. در بسیاری از پژوهشهای مرتبط با درد، عمدتا از جوندگان ماده استفاده میشود زیرا آنها دارای حالت تهاجم کمتری بوده و نگهداری و مدیریت آنها نسبتبه نرها راحتتر است.
بحث ایمنی در آزمایشهای بالینی اولیه موضوع اصلی است، بنابراین شرکتها اغلب افرادی که ممکن است باردار شوند را از مطالعه حذف میکنند. بهعنوان یک پیامد، داروها بیشتر روی مردان یا زنانی که یائسه میشوند، مورد آزمایش قرار میگیرد.
حتی اگر دانشمندان داروهایی را توسعه دهند که مسیرهای درد خاص نر یا ماده را مورد هدف قرار دهند، باز هم کافی نیست. شاید بهترین کار این باشد که داروها را سفارشیتر کنیم و عوامل مختلفی نظیر ژنتیک، سطوح هورمونی و توسعهی آناتومیکی را نیز در نظر بگیریم.
پژوهشهای کمی درمورد مکانیسمهای درد در افرادی که در یک گروه کاملا متمایز جنسی قرار نمیگیرند، انجام شده است. در یک مطالعه در ایتالیا افراد تراجنسیتی که تحت درمان هورمونی قرار گرفته بودند، مورد بررسی قرار گرفتند. آنها دریافتند که از ۴۷ نفر، ۱۱ موردی که جنس آنها از مرد به ماده تبدیل شد، پس از این تغییر دچار مشکلات مرتبط با درد شدند. ۶ نفر از ۲۶ فردی که جنس آنها از ماده به نر تبدیل شده بودند، گزارش کردند که مشکلات درد آنها پس از مصرف تستوسترون کاهش پیدا کرد.
موگیل براساس آزمایشی که با اخته کردن و درمان با تستوسترون انجام داده است، به این نتیجه رسیده که مسیرهای درد بهوسیلهی سطوح هورمونها تعیین میشود. او پیشبینی میکند افرادی که تستوسترونشان بالاتر از یک سطح خاص است، مکانیسمهای دردی خواهند داشت که با مردان مرتبط بوده و آنهایی که تستوسترونشان پایینتر از این آستانه است، درد را ازطریق مکانیسمهای معمول موجود در مادهها تجربه خواهند کرد. همچنین بهنظر میرسد که در طول زندگی، پاسخ نسبتبه درد تغییر میکند و براساس سطوح هورمونی دچار تغییر میشود. مطالعاتی که تنها روی جنس بیولوژیکی انجام شده، نشان دادهاند که در زمان بلوغ، میزان حس درد ناشی از بیماری در دختران نسبت به پسران بالاتر میرود. همانطور که سن جنس ماده افزایش پیدا میکند و به یائسگی میرسد، سطوح هورمونی دوباره تغییر میکند و اختلافهای جنسی در میزان درد مزمن شروع به ناپدید شدن میکند. بارداری نیز پاسخهای درد را تغییر میدهد.
گروه موگیل در سال ۲۰۱۷ گزارش کردند که در اوایل دوران بارداری، مکانیسم درد مستقل از میکروگلیا که در مادهها رایج است، به مسیر احساس دردی که مرتبط با میکروگلیا است، تغییر مییابد. در اواخر بارداری، بهنظر نمیرسد که جانوران در کل درد مزمنی را احساس کنند. اما او دیگر در میان معدود دانشمندانی نیست که بهدنبال چنین تفاوتهای جنسی باشد. بلکه پژوهشگران دیگر نیز به این نکته پی بردهاند و این مسیر را دنبال میکنند.