رویکردی متفاوت برای مبارزه با سرطان با الهام از حیوانات

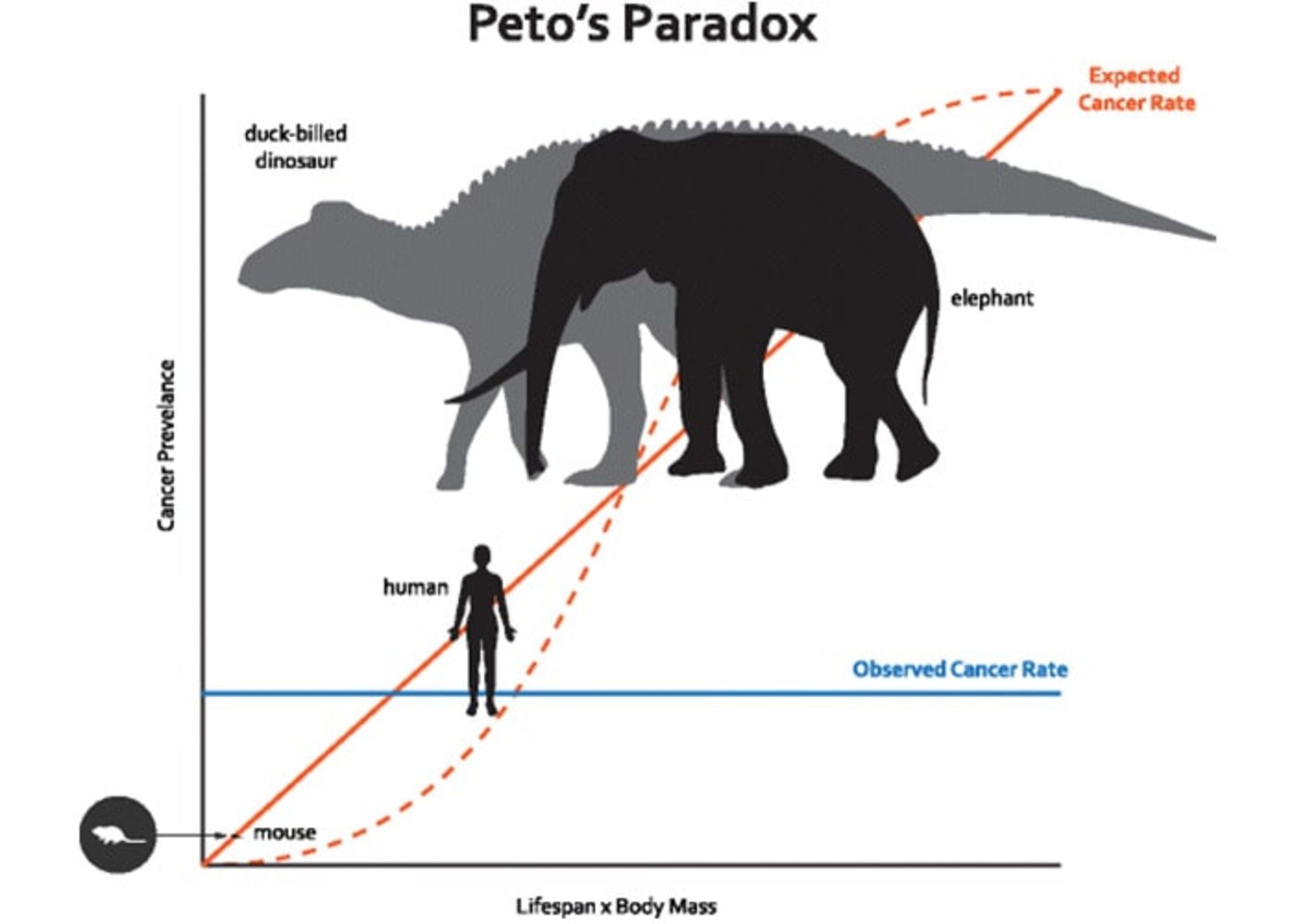
در سال ۱۹۷۷، ریچارد پتو، اپیدمیولوژیست دانشگاه آکسفورد، متوجه تناقضی شد. سرطان با اتفاقافتادن جهشی در سلولی منفرد آغاز میشود؛ بنابراین، باید خطر ابتلا به سرطان در موجوداتی بیشتر باشد که سلولهای بیشتری دارند. بر این اساس، فیلها که تعداد سلولهایشان ۱۰۰ برابر سلولهای انسان است، باید محل ازدحام تومورهای بدخیم باشند. همچنین، نهنگها که ۱۰ برابر بیشتر از فیلها سلول دارند، باید مملو از تومور باشند. با این حال، در حقیقت حیوانات عظیمالجثهی روی زمین کمترین نرخ سرطان را دارند. به نظر میرسد تکامل اندازهی بدن و مقاومت به سرطان با هم اتفاق افتاده باشد؛ بنابراین، راز سرکوب سرطان ممکن است در ژنهای حیوانات بزرگ نهفته باشد.
پژوهشگران با الهام از پارادوکس پتو و با تأکید بر گونههای سنگینوزن، در حال بررسی نرخ سرطان و مقاومت به آن در هزاران گونهی حیوانی هستند. طبق پارادوکس پتو با افزایش جثهی جانور، احتمال بروز سرطان بیشتر نمیشود. پژوهشگران امیدوار هستند کشف علت توانایی مبارزه با سرطان در این حیوانات، به پیشرفت درمانهایی برای انسان منجر شود.
در مطالعهی جدیدی که در مجلهی Molecular Biology and Evolution منتشر شده، مارک تولیس و همکارانش از دانشگاه آریزونای شمالی ژنوم نهنگ کوهاندار را تعیین توالی کردند و مشغول یافتن ژنهای سرکوبکنندهی تومور شدند. پژوهشهای قبلی نشان داده حدود ۵۰ میلیون سال پیش، موجوداتی که تا حدی به ترکیب موش صحرایی و گرگ شبیه بودند، راه خود را به دریا پیدا کردند و درنهایت، طی تکامل به نهنگ تبدیل شدند. این حیوانات تقریبا تا سه میلیون سال پیش نسبتا کوچک بودند؛ اما پس از آن بهسرعت بزرگ شدند.
دکتر تولیس دریافت وقتی نهنگهای قدیمی رشد کردند، تغییرات مختلفی در ژنهای سرکوبکنندهی تومور آنها رخ داد. او و همکارانش ۳۳ ژن شناختهشدهی سرکوبکنندهی تومور را در نهنگهای کوهاندار شناسایی کردند که نشاندهندهی شواهدی از تغییرات سودمند است. این ژنها شامل ژن ATR بودند که آسیب به DNA را تشخیص میدهد و موجب توقف چرخهی تقسیم سلولی ناشی از جهشهای ترویجکنندهی سرطان میشود؛ ژن AMER1 که رشد سلولی و RECK که متاستاز (گرایش سلولهای سرطانی برای جداشدن از تومور اولیه و پراکنش در دیگر مناطق بدن) را مهار میکند. همچنین، نهنگهای کوهاندار نسخههایی از ژنهای مشارکتکننده در آپوپتوز دارند. آپوپتوز فرایندی است که به سلولهای جهشیافته دستور خودکشی میدهد. همهی این موارد نشان میدهد تکامل موجودات عظیم با فشار انتخاب شدیدی در جهت ژنهایی همراه بوده که سرطان را مغلوب میکنند.
زیستشناسان سرطان با ژنهای ATR و AMER1 و RECK آشنا هستند؛ زیرا انسان نیز این ژنها را دارد؛ اما نهنگها ممکن است ژنهای مبارزهکننده با توموری داشته باشند که تاکنون شناخته نشده باشد. بنابراین، گام بعدی این است که لاینهای سلولی نهنگها در آزمایشگاه زیر تابش اشعه قرار گیرد. این کار موجب ایجاد جهشهای ایجادکنندهی سرطان و یافتن ژنهایی میشود که برای مقابله با این جهشها فعال میشوند. هدف نهایی کشف این نکته است که کدام ژنهای نهنگ و از چه استراتژیهایی برای مبارزه با سرطان استفاده میکنند.
پژوهشگران این کار را با انتقال ژنهای نهنگ به لاینهای سلولی انسانی انجام و آن سلولها را زیر تابش اشعه قرار میدهند. سپس، این موضوع را بررسی میکنند که آیا ژنهای نهنگ تلاش خواهند کرد آسیب وارده به DNA را ترمیم کنند (مثل همان کاری که ژنهای انسانی اغلب انجام میدهند) یا اینکه از روشی مؤثرتر برای آغاز آپوپتوز استفاده میکنند.
هماکنون، مطالعات مشابهی با استفاده از پروتئینهای مبارزهکننده با سرطان در گروه دیگری از حیوانات عظیمالجثه، یعنی فیلها، در حال انجام است. نرخ مرگومیر ناشی از سرطان در این جانوران حدود ۵ درصد است (در مقایسه با نرخ ۱۱ تا ۲۵ درصد در جوامع انسانی). برخی از پژوهشگران مشارکتکننده در مطالعهی نهنگ قبلا در توالییابی ژنوم فیلهای آسیایی و آفریقایی نیز همکاری کرده بودند. آنها دریافتند یکی از سلاحهای مهم موجود در زرادخانهی فیلها ژن TP53 است. این ژن، کدکنندهی پروتئین القاکنندهای آپوپتوز بهنام p53 است. این پروتئین به «نگهبان ژنوم» نیز معروف است.
انسانها دو نسخه از ژن TP53 را در کروموزومهای خود دارند که هر کدام را از یکی از والدین خود به ارث بردهاند. افرادی که در آنها یک نسخه از این ژن کار نمیکند، دچار سندرم لیفرامنی میشوند و به احتمال زیاد دچار سرطان خواهند شد. در مقابل، کروموزومهای فیل ۴۰ نسخه از ژن TP53 دارد که این امر قطعا یکی از دلایل نادربودن تومور در فیلها است.
جاشوا شیفمن، متخصص سرطان کودکان در مؤسسهی سرطان هانتسمن در یوتا و پژوهشگر مشارکتکننده در مطالعهی فیل، مشغول بررسی این موضوع است که چگونه چندین نسخهی TP53 به کمک هم به سلولهای سرطانی حمله میکنند و چگونه تفاوتهای جزئی در ترکیب p53 فیل، آن را درمقایسهبا همتای انسانی به ابزار کارآمدتری برای ازبینبردن سلولهای سرطانی تبدیل میکند.

قدرت ژن p53 در فیل موجب شد دکتر شیفمن شرکتی با نام PEEL Therapeutics تأسیس کند. کلمهی پیل (Peel) برگرفته از واژهای عبری است که در مفهوم فیل به کار میرود. هدف شرکت پیل ترجمهی یافتههای مطالعات سرطانشناسی مقایسهای به بیماری انسانی است. پژوهشگران این شرکت در حال آزمایش اجسام لیپیدی کُروی ریزی هستند که حاوی پروتئینهایی ازجمله p53 مصنوعی فیل است. امیدبخشترین داروی تجربی آنها برای تحویل مستقیم این پروتئین به سلولهای تومور بیمار طراحی شده است. جزئیات کار هنوز مشخص نیست؛ اما دکتر شیفمن میگوید در آزمایشگاه، تحویل p53 مصنوعی فیل به سلولهای سرطانی انسانی موجب مرگ سریع سلولها شد.
مطالعات در حال انجام روی فیلها و نهنگها بخشی از تلاشی بزرگتر در مطالعات سرطانشناسی مقایسهای است که بخشی از این پروژه در مرکز تکامل سرطان دانشگاه آریزونا انجام میشود. پژوهشگران این مرکز از جمله دکتر تولیس و کارلو مالی، مدیر مرکز، مشغول بررسی نرخهای سرطان ۱۳ هزار گونهی جانوری با استفاده از بیش از ۱۷۰ هزار حیوان هستند. این مطالعه که در نوع خود اولین است، قصد دارد الگوهایی بیابد که ممکن است مقاومت و حساسیت به تومورها را توضیح دهد؛ به همین منظور، پژوهشگران از روشهای مختلفی استفاده کردهاند. برای مثال، آنها تلاش کردند تومورهایی به اسفنجهای دریایی القا کنند که در آنها شیوع سرطان گزارش نشده است.
افزون بر این، دکتر تولیس و دکتر مالی و همکارانشان بهدنبال ژنهای سرکوبکنندهی تومور در ژنومهایی هستند که قبلا تعیین توالی شدهاند و اطلاعات آنها در پایگاههای دادهی عمومی وجود دارد. این اطلاعات شامل حدود ۶۵ گونه از پستانداران میشود که برخی از آنها، مانند موش صحرایی برهنه، حتی با اینکه اندازهاش کوچکی است، نرخ سرطان کمتری دارد و به نظر نمیرسد با پارادوکس پتو همخوانی داشته باشد. در این جستوجو، استثناهای غیرپستانداری مانند تمساحها و پرندگان نیز بررسی خواهد شد. دکتر تولیس و دکتر مالی حدس میزنند پرندگان احتمالا تا حدودی مقاومت به سرطان را از اجداد دایناسور خود به ارث بردهاند که بسیار بزرگتر بودهاند. آنها برای آزمون این فرضیه روی مدلهای محاسباتی کار میکنند.
یکی از جنبههای جدید این پژوهش، تمایل آن به مطالعهی خود حیوان است. علم پزشکی زیاد از حیوانات استفاده میکند؛ اما تقریبا همیشه آنها بهعنوان جایگزینی برای انسان عمل میکنند؛ نقشی که با کلمهی «مدل» تعریف میشود. در سرطانشناسی مقایسهای، این ایده بهصراحت رد میشود و بهجای آن پدیدهای، یعنی سرطان و پاسخ بدن در برابر آن بدون تعصب مطالعه و سعی میشود از آن برای نتیجهگیریهای پزشکی استفاده شود. گسترش این رویکرد به دیگر حوزههای پزشکی قطعا ارزش توجه دارد.