پژوهشگران با تکنولوژی چاپ سه بعدی زیستی، قلبی از جنس سلول های انسانی ساختند
هفده سال پیش، دکتر توماس بولند (Thomas Boland)، پروفسور مهندسیزیستی دانشگاه کلمنسون، با اعمال تغییراتی در عملکرد یک پرینتر جوهرافشان و استفاده از ژلی حاوی سلولهای زنده بهعنوان جوهر، اولین اختراع را در حوزه چاپگرهای زیستی، بهنام خود ثبتکرد. سه سال بعد و در سال ۲۰۰۷، دکتر شینیا یاماناکا موفق شد با بازبرنامهریزی سلولهای بالغ انسانی، آنها را به دوران جنینی بازگرداند و بهاینترتیب ثابتکرد روند بلوغ سلولها یکطرفه نیست. کشف این روش برای دستیابی به سلولهای بنیادی، که قابلیت تبدیلشدن به هرنوع سلولی در بدن را دارند و به موازات آن پیشرفتهای قابلتوجه در حوزهی تکنولوژیهای پرینت سهبعدی، رویای ساخت چاپگرهای سهبعدی زیستی را طی سالهای آتی به واقعیت بدلکرد.

دکتر توماس بولند و اولین چاپگر زیستی تاریخ
چاپگرهای زیستی در بیانی ساده، پرینترهای سهبعدی پیشرفتهای هستند که فیلامنت مورد استفاده در آنها، مادهای حاوی سلولهای زنده است. این ماده که بایواینک یا جوهر زیستی نامیدهمیشود باید عملکردی مشابه ماتریکس خارج سلولی (ECM) داشتهباشد تا بتواند محیط مناسب جهت تغذیه، رشد و تکثیر سلولها را ایجادکند. ماتریکس خارج سلولی، شبکهای متشکل از پروتئینها، کربوهیدراتها، آب و مواد معدنی است که علاوهبر شکلدهی ارتباطات میان سلولی، که برای رشد و تقسیم سلولها حیاتی هستند، ساختار و نحوهی عملکرد هر بافت را نیز تعیینمیکند. یکی از اجزاء اصلی ماتریکس خارج سلولی، پروتئینی بهنام کلاژن است که حدود یکسوم از ترکیب پروتئینی بدن را تشکیلداده و یکی از عناصر اصلی در ساختار استخوانها، پوست، عضلات، تاندونها و رباطها بهشمارمیرود و در رگهای خونی، قرنیه و دندانها نیز یافت میشود. نام این پروتئین که مانند چسبی قدرتمند اجزاء بدن را در کنار یکدیگر نگهداشته، برگرفته از واژه یونانی «kólla» بهمعنای «چسب» است. در تکنولوژیهای پرینت سهبعدی زیستی نیز، معمولا ترکیبات کلاژن بهصورت داربستی ژلهای برای حفظ ساختار بافتهای پرینتشده بهکار میروند.
کشف سلول های بنیادی و به موازات آن پیشرفت تکنولوژی های پرینت سه بعدی، رویای ساخت چاپگرهای سه بعدی زیستی را به واقعیت بدلکرد.
پیچیدگی ساختار و نحوهی عملکرد ماتریکس خارج سلولی، یکی از موانع اساسی در مسیر تحقق رویای پرینت سهبعدی ارگانهای بدن، با بکارگیری سلولهای بنیادی انسانی است. رویایی که تحقق آن، بهمعنای فراهمآمدن امکان ساخت اعضای پیوندی با استفاده از سلولهای بدن شخص دریافتکننده است، که ریسک پسزدن عضو پیوندی را به صفر میرساند. هرچند طی سالهای اخیر، برخی ارگانهای دارای پیچیدگی کمتر با بکارگیری این تکنولوژی تولیدشدهاند و پیوند مثانهی ساختهشده با چاپگر زیستی به بدن بیمار نیز موفقیتآمیز بودهاست، اما در مورد ارگانهای پیچیدهتر مانند قلب، کلیه و ششها، تحقیقات همچنان ادامه دارد. بهعلاوه تبدیل ارگان طبیعی تولیدشده با این روش به اندامی واقعی، که از طریق عروق خونی تغذیهمیکند و مبنای عملکردش پیامهای دریافتی از سیستم اعصاب بدن انسان است، فرآیندی پیچیده بوده و پیشرفت تحقیقات در این حوزه را با کندی مواجه کردهاست.
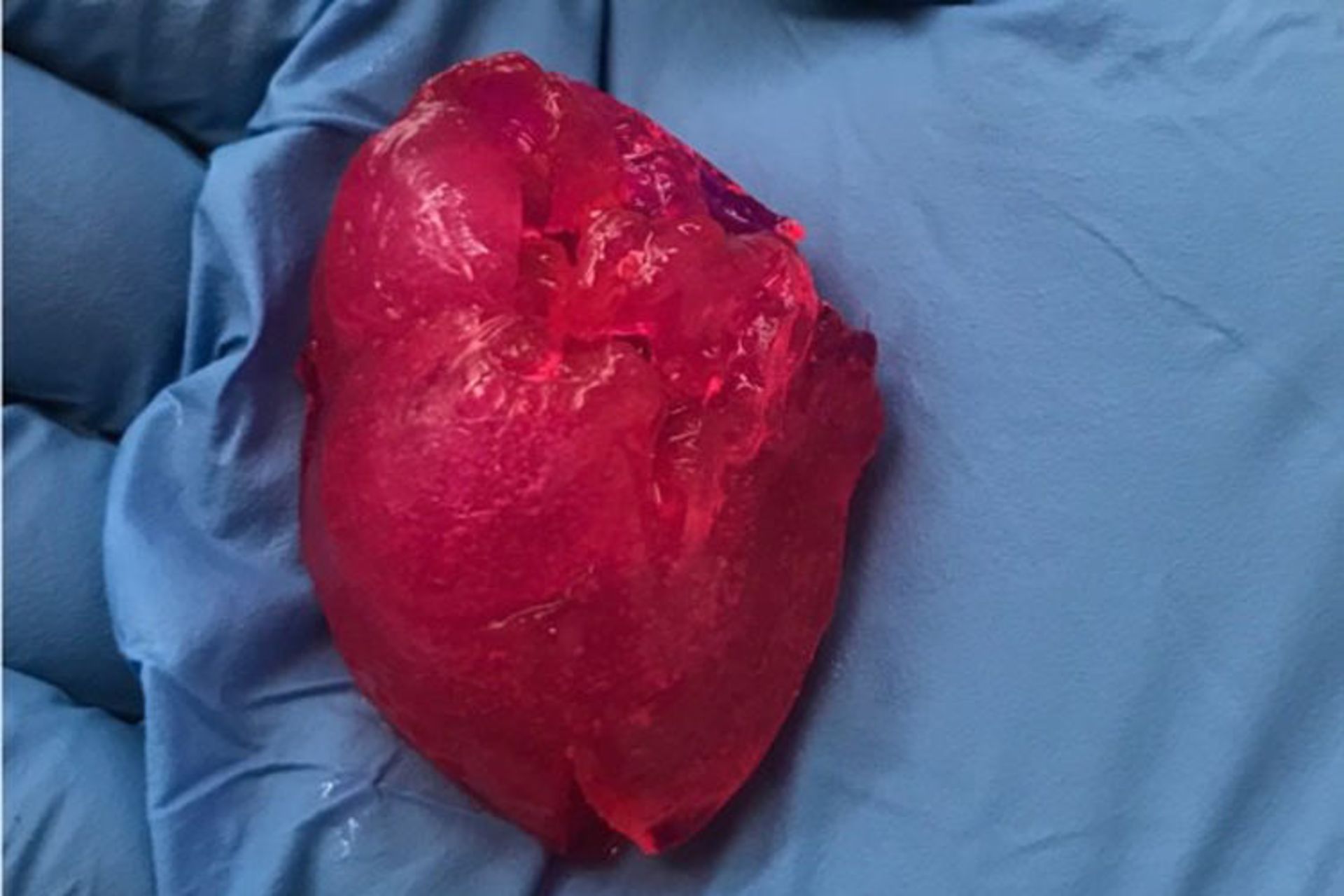
اخیرا محققان مؤسسه BIOLIFE4D در شیکاگوی آمریکا، به سرپرستی دکتر راوی بیرلا (Ravi Birla)، موفقشدند با بکارگیری تکنولوژی چاپ سهبعدی زیستی و با استفاده از سلولهای بنیادی پرتوان القائی، قلب کوچکی در ابعاد یک کف دست تولیدکنند. در زیستشناسی سلولی، سلول پرتوان به سلول بنیادیای اطلاقمیشود که پتانسیل تبدیلشدن به یکی از سه لایهی جنینی درونپوست (پوشش درونی شکم، دستگاه گوارش، ریهها)، میانپوست (ماهیچهها، استخوان، خون)، یا برونپوست (بافتهای اپیدرمی و سیستم عصبی) را دارد. یکی از انواع این سلولهای پرتوان، سلولهای بنیادی پرتوان القایی (iPS یا iPSCs) هستند که بهصورت مصنوعی از یک سلول غیرپرتوان (معمولا سلول بالغ موجود زنده) بهدست میآیند و ویژگیها و خصیصههایی مشابه سلولهای بنیادی جنینی (ESCs) دارند. همچنانکه پیشتر اشارهشد، دکتر شینیا یاماناکا، برای اولینبار در سال ۲۰۰۷ موفق به ارائهی روشی برای القای سلولهای بالغ انسانی به وضعیت پرتوانی شد.
در تحقیقاتی که اخیرا به سرپرستی دکتر راوی بیرلا انجام گرفتهاست، ابتدا گلبولهای سفید دریافتشده از فرد داوطلب، به سلولهای بنیادی پرتوان القائی تبدیلمیشوند و این سلولها پس از تقسیم، سلولهای بافت ماهیچهای قلب را ایجادمیکنند. سلولهای ایجادشده بهمراه مواد مغذی و ترکیبات موردنیاز برای رشد سلولی، جوهر زیستی اختصاصی شرکت BIOLIFE4D را تشکیلمیدهند. این جوهر بهمراه مادهای شفاف که عملکردی مشابه ماتریکس خارج سلولی دارد، از نازل چاپگر زیستی خارجشده و حجمی به شکل قلب فرد داوطلب را، بهصورت لایهبهلایه شکلمیدهد. ابعاد و شکل حجم سهبعدی ارائهشده به چاپگر زیستی، با استفاده از تصاویر MRI قلب فرد داوطلب تعیینمیشوند. حجم تولیدشده سپس در یک بیورآکتور با قابلیت شبیهسازی شرایط زیستی داخل بدن انسان قرارمیگیرد تا سلولهای بافت ماهیچهای، امکان خودساماندهی و ترکیب با یکدیگر برای ایجاد بافتی یکپارچه را بیابند. پس از شکلگیری کامل قلب، مادهی شفافِ شبیهساز ماتریکس خارج سلولی، بهصورت محلول قابل جداسازی خواهدبود. حجم تولیدشده مانند قلب واقعی دارای چهار محفظه بوده و طبق ادعای شرکت BIOLIFE4D، عملکردهای قلبی در ابعاد واقعی را نیز، تا حدی خواهدداشت. هرچند هنوز مشخص نیست که آیا این قلب امکان تپیدن در بدن فرد دریافتکنندهی پیوند را نیز دارد یا خیر.

واقعیت دربارهی تولید آیفون در آمریکا چیزی فراتر از تصمیم سیاسی است؛ چرا حتی اپل هم نمیتواند این رؤیا را عملی کند؟

برای رصد فعالیتهای ورزشی و ازدستندادن تماسها و کنترل راحتتر گوشی، در این راهنمای خرید ساعت هوشمند سراغ بهترین گزینههای موجود در بازار رفتهایم.

آزمایش ذهنی گربه شرودینگر، یکی از چالشبرانگیزترین معماهای دنیای کوانتوم است: آیا گربه میتواند همزمان زنده و مرده باشد؟

سامسونگ سرانجام ابزار Good Lock را برای کاربران سرتاسر جهان منتشر کرد؛ ابزاری که امکانات شخصیسازی بسیار زیادی برای گوشیهای گلکسی ارائه میدهد.

در این مقاله نحوهی ساخت تصاویر اکشن فیگور با چت جی پی تی را یاد میگیرید. دو پرامپت مفید هم برای شروع کار در اختیار خواهید داشت.

مطالعهای جدید نشان میدهد توانایی شناختی کلاغها به قدری خوب است که بتوانند اشکال مختلف هندسی را بدون هیچ آموزش قبلی، از یکدیگر تشخیص دهند.

در یک سال گذشته بسیاری از زنان در اصفهان بدون خودرو، بارها پیامکهای تذکر حجاب دریافت کردهاند. این سیستم نظارتی چگونه کار میکند؟




























































































-652d21c5eb21a6b54f515846?w=1920&q=75)















