فناوری چگونه مراقبت بهداشتی را متحول میکند

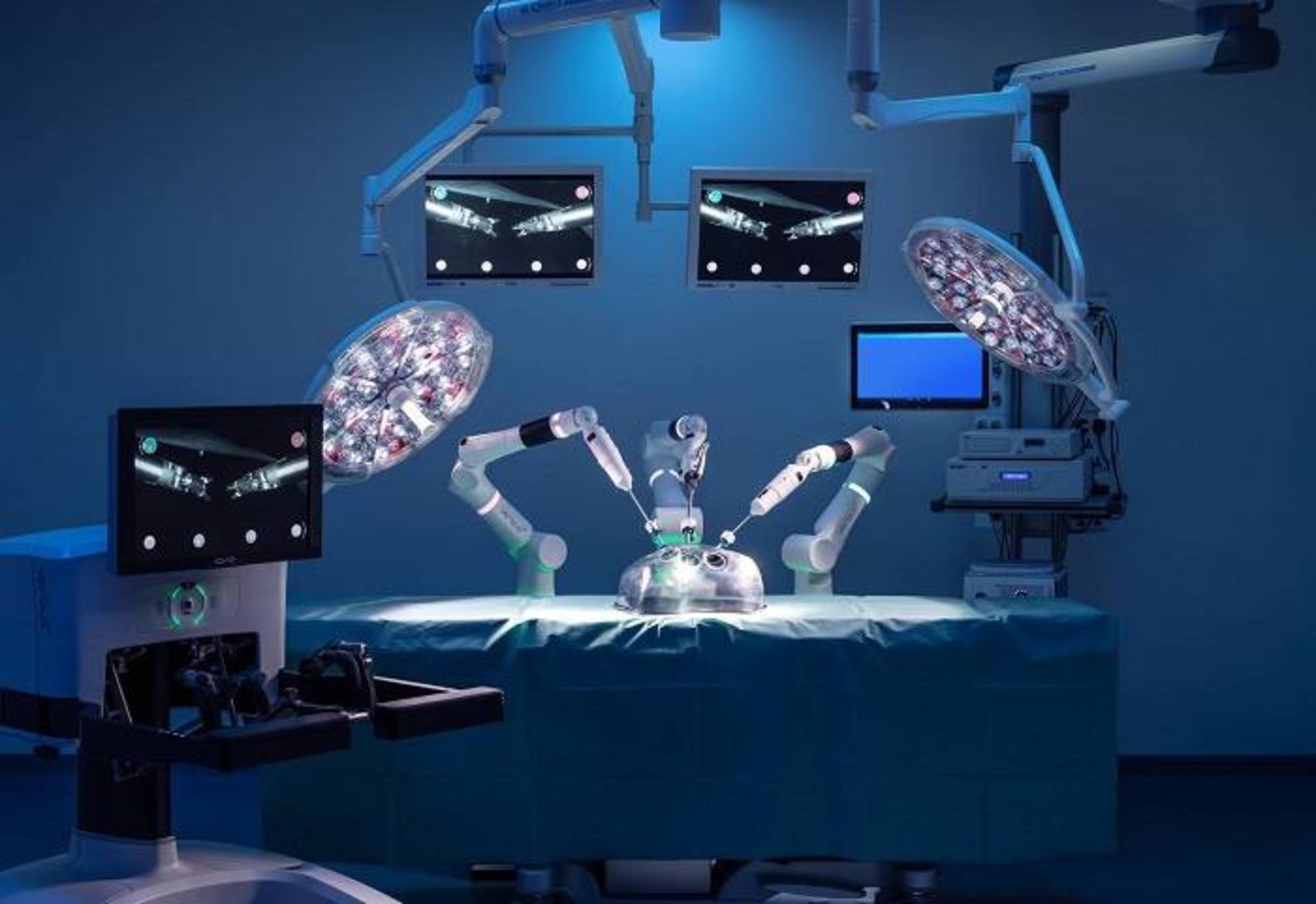
مارک اسلک، متخصص پزشکی زنان و همبنیانگذار استارتاپ جراحی رباتیک CMR Surgical، میگوید: «وقت آن است که از شر زخمها راحت شویم.» شرکت CMR Surgical که در کمبریج واقع شده است، در سال ۲۰۱۴ تأسیس شد. اسلک به خاطر میآورد که در زمان تأسیس شرکت، جراحان به دنبال رباتی بودند که برای همهی حوزههای جراحی مناسب باشد: رباتی با هزینهی برابر جراحی سنتی که در هر اتاق عملی قابل استفاده و مونتاژ و جدا کردن اجزای آن راحت باشد. در آن زمان چنین چیزی وجود نداشت و اسلک به فکر افتاد چنین رباتی بسازد.
حاصل تلاش اسلک و همکارانش ورسیوس است؛ ربات جراح که به منظور کمک جراحی به روش سوراخ کلید (جراحی با ایجاد برش کوچک) طراحی شده است.
اسلک میگوید جراحی به روش سوراخ کلید عموما به جراحی باز ارجحیت دارد. بهطور کلی، اگر بهجای جراحی باز، از جراحی روش سوراخ کلید استفاده شود، حدود ۵۰ درصد از عوارض پس از جراحی کاهش پیدا میکند. وی میگوید: «اگر زخم کوچکی با حداقل دسترسی داشته باشید، تقریبا هیچیک از بیماران به بیمارستان برنمیگردند. اگر زخم بزرگی داشته باشید، احتمالا حدود یکپنجم بیماران به علت عفونت زخم به اتاق عمل بازمیگردند.»
بهگفتهی اسلک، مشکل این است که کمتر از ۵۰ درصد از بیماران در سراسر جهان از مزیت جراحی با حداقل دسترسی بهرهمند میشوند؛ زیرا این روش جراحی از نظر فنی دشوار و برای جراح طاقتفرسا است. اسلک میگوید: «پس از سالها آموزش جراحان به روش حداقل دسترسی، متوجه شدم بسیاری از افراد بهراحتی نمیتوانند در آن مهارت پیدا کنند.»
رباتیک راهحل بالقوهای ارائه میدهد. ورسیوس چند بازو دارد که هر یک دارای هفت درجه آزادی است و به جراح اجازه میدهد رویههایی انجام دهد که به کمک لاپاراسکوپی استاندارد ممکن نیست. ربات همچنین به دید سهبعدی مجهز است که به جراحان کمک میکند تتجسم بهتری از میدان جراحی پیدا کنند و بتوانند رویههای پیچیدهتر را انجام دهند.
اسلک امیدوار است ورسیوس بسیاری از مشکلات پیش روی جراحی امروز را حل کند. برای مثال، هر سال هزاران بیمار براثر عوارض پس از جراحی آسیب میبینند. وی میگوید: «جراحی با حداقل دسترسی عوارض را حدود ۵۰ درصد کاهش میدهد. علاوهبراین، اگر بتوانیم جراحی را استاندارد کنیم، عوارض کاهش بیشتری نیز پیدا میکند.»
جراحی رباتیک از جراحی بهوسیلهی انسانهای ماهر مزایای بیشتری دارد. این روش یک رابط دیجیتال بین بیمار و جراح ایجاد میکند و میتواند بهطور مداوم دادههای مهم را جمعآوری کند که در غیر این صورت از دست میروند: تجزیهوتحلیل تصویر، حرکات کاربر، دوریسنجی از ابزارهای رباتیک و موارد دیگر. اسلک میگوید: «رابط دیجیتال به ما این توانایی را میدهد که حرکات دست جراح را بررسی کنیم. اکنون دادههایی داریم که به ما نشان میدهند چگونه میتوان تفاوت کاربر تازهکار و ماهر را تشخیص داد. این بدان معنا است که میتوانیم جراحانی که عادات بدی دارند و شاید از برخی جهات، از ربات بیشازحد استفاده میکنند، شناسایی و روشهایی اتخاذ کنیم که برای بیمار بهتر باشد.»
شرکت CMR همچنین آموزشدهندهی ورسیوس را ساخته است؛ شبیهسازی که جراحان میتوانند از آن برای آشنایی با دستگاه استفاده کنند. اپلیکیشنی که مایورسیوس نام دارد، ویدئوهایی ذخیره میکند که جراحان میتوانند آنها را برای بهبود رویههای جراحی خود تجزیهوتحلیل کنند. اسلک میگوید: «این امر آنها را قادر میسازد تا دفترچه یادداشت دیجیتال داشته باشند و خود را با بهترین رویهها محک بزنند. این همچنین بدان معنا است که جراحان (اگر نتایج کمی بدی داشته باشند) بهراحتی به مسیر درست برگردند؛ زیرا میتوانند از دیگران کمک بگیرند و ببینند چرا نتایج آنها ضعیف شده است.»
در حال حاضر فقط ۵ تا ۷ درصد از کل جراحیها بهصورت رباتیک انجام میشود. ورسیوس در بیش از ۸۰۰ عمل جراحی و بیمار در چندین مکان در سراسر جهان و بهوسیلهی چهار بیمارستان NHS (سرویس سلامت همگانی بریتانیا) و نیز در هند و مناطق دیگر اروپا مورد استفاده قرار گرفته است. اسلک میگوید: «معتقدم طی پنج سال آینده شاهد شتاب عظیمی در جراحی رباتیک خواهید بود؛ تا جایی که جراحی رباتیک کاملا جای رویههای لاپاراسکوپی دستی را خواهد گرفت.»
البته رباتهای جراح تنها دستاوردهای بزرگ فناوری نیستند که مراقبتهای بهداشتی را دگرگون میکنند؛ بلکه پیشرفتهای بزرگ دیگری در این حوزه وجود دارد که در ادامه به آنها میپردازیم.
استفاده از کریسپر برای حذف بیماری از DNA
دو هفته قبل از دریافت جایزه نوبل شیمی سال ۲۰۲۰، جنیفر دودنا (بیوشیمیدان) از خانه خود در کالیفرنیا با وایرد هلث صحبت کرد تا در مورد کشف خود از تکنیک ویرایش ژن کریسپر صحبت کند که او آن را به «جراحی مولکولی» تشبیه میکند. او گفت:
کریسپر در واقع راهی برای تغییر DNA در سلولها و موجودات است و تصحیح دقیق جهشهای عامل بیماری را ممکن میسازد. کریسپر همچنین به دانشمندان امکان میدهد تا انواع دستکاری ماده ژنتیکی را در سلولها و موجودات زنده انجام دهند. آنها میتوانند به کمک کریسپر جزئیات ذخیرهشده در ژنوم هر نوع سلول و هر موجود زنده را تغییر بدهند و به ما امکان میدهد تا آن اطلاعات را درک و دستکاری کنیم.
بهگفتهی دودنا، توسعهی کریسپر از حوزهی پژوهشی گمنامی آغاز شد که به مطالعهی نحوهی مبارزهی باکتریها با عفونتهای ویروسی میپردازد. در باکتریها، CRISPR-Cas9 نوعی سیستم دفاعی است که ایمنی فراهم میکند. او ادامه داد:
آنها این کار را با ایجاد ضبط مولکولی کوچکی از ویروس با استفاده از DNA ویروسی انجام میدهند. سلول قطعهای از DNA ویروسی را در بخشی از DNA باکتریایی ذخیره میکند که «جایگاه کریسپر» نامیده میشود. سپس DNA ذخیرهشده الگویی برای ساخت مولکولهای RNA فراهم میکند که برای پیدا کردن و تخریب DNA دارای توالی مطابق با آن، ساخت پروتئینهایی به نام پروتئینهای همبسته با کریسپر را هدایت میکنند. به این ترتیب، سلول یک کارت واکسیناسیون ژنتیکی ایجاد میکند که به او اجازه میدهد از نظر مولکولی، ویروسهایی که در گذشته آن را آلوده کردهاند، به خاطر داشته باشد و در صورت مواجهه با آنها در آینده، محافظت فراهم کند.
بهگفتهی دودنا، آنچه از آن پژوهش حاصل شد، پی بردن به این واقعیت بود که کریسپر توانایی ایجاد تغییرات دقیق در DNA دارد. دودنا میگوید: «این واقعا آغاز عصر ویرایش ژنوم به روش کریسپر بود. ما اکنون تکنیکی داریم که بهراحتی در دسترس دانشمندان سرتاسر جهان است.»
یکی از کابردهای کنونی کریسپر در بیماری سلول داسیشکل (بیماری ناشی از جهش ژن کدکنندهی پروتئینی برای هموگلوبین) است. در بیماران دچار جهش، این نقص موجب تشکیل سلولهای قرمز خون داسیشکلی میشود که مسیر عبور خون را میبندند.
اخیرا چند شرکت کارآزماییهای بالینی استفاده از کریسپر برای درمان بیماری سلول داسی را آغاز کردهاند. دودنا میگوید: «یک بیمار تحت کریسپردرمانی برای بیماری سلول داسی قرار گرفت و بیماری او بهطور مؤثری درمان شد. این امر موجب هیجان زیادی شد و دانشمندان را به این فکر انداخت که چگونه میتوان از این فناوری برای درمان بیمارانی که دچار این بیماری یا دیگر بیماریهای ژنتیکی نادر هستند، استفاده کرد.» دودنا فکر میکند بیماریهای دیگری مانند دیستروفی عضلانی بهزودی از کاربرد کریسپر بهرمند شوند. او میگوید: «حدس میزنم طی پنج سال آینده، بتوانیم درمورد کارآزماییهای بالینی و شاید نتایج واقعی صحبت کنیم.»
فناوری کریسپر همچنان آزمایشی و گران است و هنوز نمیتواند بخشی از گزینههای معمول درمانی هر فردی باشد؛ اما دودنا خوشبین است که روزی این اتفاق خواهد افتاد.
اخیرا دانشمندان از کریسپر بهعنوان ابزاری برای تشخیص بیماری استفاده کردهاند. بهگفتهی دودنا، برخی از پروتئینهای کریسپر این توانایی را دارند که توالی هدفی مطابق با توالی RNA راهنما را شناسایی کنند. او میگوید: «از این سیستمها میتوان برای شناسایی ویروسها استفاده کرد.» او همچنین معتقد است که در ماههای آینده روشهای تشخیصی مبتنی بر کریسپر قابل استفاده در بالین بیمار، برای تشخیص سریع کووید ۱۹ ارائه خواهد شد. دودنا میگوید کریسپر کاربردهای مختلفی میتواند داشته باشد: از پژوهشهای پایهای در سلولها گرفته تا توسعهی داروها و آنتیبیوتیکهای جدید، کشت محصولات مغذی و ایجاد محصولات کشاورزی مقاوم دربرابر بیماری.
رقابت برای ساخت واکسنی علیه کووید ۱۹
در اکتبر ۲۰۲۰، بیش از ۱۹۰ واکسن کووید ۱۹ درحال ساخت و حدود ۴۰ مورد از آنها در مرحلهی آزمایش انسانی بودند. طلایهدار این رقابت، شرکت آمریکایی مدرنا و شرکت آلمانی بیوانتک هستند. تال زاکس، مدیر ارشد پزشکی مدرنا، میگوید: «انتقال بالای عفونت، پارادوکس ساخت واکسن است. هرچه وضعیت انتقال بدتر باشد، سریعتر متوجه خواهیم شد که واکسن مؤثر است.» این موضوع یکی از دلایلی است که واکسنی علیه ویروسهای کرونای دیگر مانند سارس و مرس وجود ندارد: تعدادی کافی از افراد به ویروس آلوده نشدند. چنین چیزی درمورد کووید ۱۹ وجود ندارد. زاکس افزود: «اگر کسی آلوده نمیشد، هرگز متوجه نمیشدیم که واکسن مؤثر است. هرچه موارد عفونت بیشتر و انتقال بالاتر باشد، سریعتر میتوانیم نشان بدهیم که واکسنها واقعا ایمن و مؤثر هستند.»
در کارآزمایی بالینی مرحله سوم واکسن بیوانتک بیش از ۴۴ هزار نفر شرکتکننده حضور داشتند. مدرنا نیز با همکاری NIH کارآزماییهای مرحله سوم را با ۳۰ هزار شرکتکننده انجام داد. نتایج حاصل از کارآزماییها چنین بود: نرخ کارآیی واکسن بیوانتک به ۹۰ درصد میرسید و مدرنا کارآیی حدودا ۹۵ درصد داشت. هر دو شرکت در زمینهی درمانهای مبتنی بر RNA پیامرسان پیشرو هستند که از مولکولی استفاده میکند که میتواند اطلاعات ژنتیکی را رمزگذاری کند. اوغور شاهین، همبنیانگذار و مدیرعامل شرکت بیوانتک، میگوید: «دانشمندان میتوانند بخشی از ویروس را که برای ایجاد پاسخ ایمنی مؤثر و قوی اهمیت دارد، بگیرند، آن را در قالب RNA پیامرسان رمزگذاری کنند و به شکلی به بدن تحویل بدهند که سلولهای انسان بتواند آن را جذب کند.» در نتیجه، این سلولها واکسن تولید میکنند. بهگفتهی شاهین، این روش برای ایجاد پاسخ ایمنی در بیماران، بسیار دقیق است. زاکس میگوید: «حُسن روش آن است که از ویروس استفاده نمیکنیم. ما هرگز در آزمایشگاههای خود ویروس را نداشتیم؛ ما به آن نیازی نداریم. تمام آنچه لازم است، اطلاعات ژنتیکی است.»
تولید واکسن RNA در مقایسه با واکسنهای دیگر سریعتر و این فناوری، دقیقتر و انعطافپذیرتر است. علاوهبراین، زیرساختهای مورد نیاز کوچک هستند و سریع آماده میشود.
در حالت معمول، ساخت واکسنها معمولا چند دهه طول میکشد؛ اما بهگفتهی زاکس و شاهین، چرخههای ساخت سریع آنها از آنجا ناشی میشود که مراحل مختلف ساخت واکسن متوالی نیست و بهصورت موازی انجام میشود. شاهین میگوید: «قبل از اینکه بدانیم واکسن مؤثر است، در حال برنامهریزی برای کارآزمایی مرحلهی سوم و تولید واکسن بودیم.» زاکس در مورد تلاش شرکتهای دیگر برای ساخت واکسن کووید، میگوید: «در اینجا فقط دو رقیب داریم: ویروس و زمان. دنیا برای موفقیت به تلاش بیش از یک شرکت نیاز دارد.» شاهین با این موضوع موافق است و به اهمیت همکاری شرکتها و مراکز مختلف اشاره دارد: «واقعا مهم است که ببینیم مردم چگونه با هم همکاری میکنند: مدرنا با NIH همکاری میکند، ما با فایزر همکاری میکنیم و آسترازنکا با دانشگاه آکسفورد به همکاری پرداخته است. ما بیشترین شفافیت را داریم. مردم شاهد دادهها در زمان واقعی هستند.»
نتایجی که تاکنون حاصل شده، دلگرمکننده بوده است. بهعنوان مثال، براساس مشاهدات اولیهی پاسخهای ایمنی بیماران، مدرنا انتظار دارد واکسنی با کارآیی بیش از ۶۰ درصد تحویل دهد. زاکس میگوید: «این کارآیی به اندازه کافی خوب است.زیرا اگر تعداد کافی از مردم مصونیت کسب کنند، سرانجام انتقال ویروس و در نهایت بیماری متوقف میشود.»
وقتی از زاکس در مورد فشارهای سیاسی برای تحویل سریع واکسن سؤال شد، وی مصمم بود که ایمنی و کارآیی هرگز طی این روند قربانی نخواهد شد. او گفت: «این مسئلهی انسانی است. همهی ما شاهد اتفاقاتی که رخ میدهد، هستیم. همهی ما بستگان یا همکارانی داریم که تحت تأثیر قرار گرفتهاند. همهی ما این روزها در جهانی کاملا متفاوت زندگی میکنیم. برخی از اعضای گروه من هرگز قدم به ساختمان نگذاشتهاند و من هنوز نتوانستهام آنها را ملاقات کنم و با آنها دست بدهم. من در حال استفاده از مزیت دورکاری هستم؛ اما نمیتوانم به مادر ۸۰ سالهام سر بزنم که در کشور دیگری زندگی میکند. این بزرگترین فشار برای گروه من و افراد در حال فعالیت در این حوزه است: این احساس مسئولیت که میتوانیم این وضعیت را تغییر دهیم.»
کیت آزمایشی که میتواند دوران پزشکی شخصی را تحقق بخشد
کریس تومازو، مدیرعامل استارتاپ DnaNudge که از اوایل حرفهی خود بهعنوان مهندس الکترونیک،در زمینه فناوری تلفن همراه متخصص بود، میگوید:
سالهایی زیادی از دوران تحصیل دانشگاهی خود را صرف تلاش برای کوچک کردن دستگاهها به اندازهی تلفن همراه کردم. دوران خوشی من در عرصه پزشکی زمانی آغاز شد که یکی از اولین ایمپلنتهای حلزون گوش را برای کودکانی که ناشنوا متولد میشوند، ساختیم. واضح بود که اگر بخشی از این فناوری را در مراقبتهای بهداشتی به کار بگیرید، میتوانید نوآوریهای بزرگی ایجاد کنید.
تومازو با اختراع دستگاههای پوشیدنی که میتوانند علائم حیاتی را نظارت کنند و آزمایش ژنتیکی انجام بدهند تا ببینند آیا دارویی توسط بیمار متابولیزه میشود، تحولاتی ایجاد کرده است. تومازو میگوید: «کل این حوزه مرا ناامید میکرد؛ زیرا پیشگیری هرگز به اندازهی درمان مهم نبود. هرگز مدلهای تجاری برای پیشگیری وجود نداشت ... من فکر کردم باید مصرفکننده را توانمند سازم تا آزمایش DNA را مردمی کنم.»
تومازو تصمیم گرفت روی بیماریهای مزمن شایع تمرکز کند که بیش از ۶۰ درصد از مردم را تحت تأثیر قرار میدهد: چاقی و وضعیتهای مرتبط مانند دیابت و فشار خون بالا. وی با همکاری دانشگاه کمبریج ریزتراشهای ساخت که میتوانست استعداد ژنتیکی ابتلا به دیابت نوع ۲، چاقی، فشار خون و کلسترول را تشخیص دهد که همه با تغذیه در ارتباط هستند. تومازو در سال ۲۰۱۵ شرکت DnaNudge را تأسیس و فروشگاهی در یکی از محلههای لندن ایجاد کرد. شرکت، دستگاه پوشیدنی DnaBand را ساخت که به مشتریان امکان میداد محصولات سوپرمارکتها را اسکن کنند و اطلاعاتی در مورد اینکه آیا آن محصولات با بیولوژی آنها سازگار است، دریافت کنند. تومازو گفت: «ما تمام درشتمغذیهای مرتبط با هر محصولی که در سوپرمارکتهای بریتانیا یافت میشود، در نظر گرفتهایم. این بدان معنا است که اساسا میتوانید بر اساس DNA خود خرید کنید.» فناوری مذکور همراه با کارتریجی به نام DnaCartridge و کیت آزمایش NudgeBox کار میکند. وی توضیح داد: «روی کارتریج، آرایه قرار گرفته است و روی آرایه، چاهکهای کوچکی وجود دارد. درون چاهکها طعمه (آشکارگر خطاهای ژنتیکی در ژنوم) را قرار میدهیم. در این آزمایش، کاربر با سواب (نمونهگیر) از گونهی خود نمونهای تهیه میکند که درون کارتریج قرار داده میشود و درون جعبه جای میگیرد. در اینجا DNA از نمونه استخراج و تجزیهوتحلیل میشود.»

در مارس ۲۰۲۰ وقتی کووید ۱۹ بریتانیا را فرا گرفت، تامازو به این فکر کرد که چگونه فناوری او میتواند به مبارزه با ویروس کرونا کمک کند. او میگوید: «فکر کردم به جای اینکه به خطاهای ژنتیکی نگاه کنم، چرا به RNA ویروس (حاوی اطلاعات سنتز پروتئینها) نگاه نکنم؟ تنها کاری که باید انجام میشد، جایگزینی طعمهای برای تشخیص کووید ۱۹ بود.»
نتیجهی این تلاش، آزمایش COVID Nudge بود که آزمایش کووید بدون نیاز به آزمایشگاه است. آزمایش مذکور مبتنی بر واکنش زنجیرهای پلیمراز (PCR) است و طی حدود یک ساعت نتیجه آن مشخص میشود و به آزمایشگاه نیاز ندارد. تامازو و گروهش COVID Nudge را به بیمارستانها بردند تا دقت آن را ارزیابی کنند و آن را روی ۴۰۰ بیمار آزمایش کردند. در مقالهای که در مجله لنست منتشر شد، گزارش شد متوسط حساسیت آزمایش ۹۵ درصد و ویژگی آن نزدیک به ۱۰۰ درصد است. تومازو معتقد است DnaNudge کاربردهایی در حوزههایی مانند تشخیص بیماریهای مقاربتی و سرطانشناسی نیز پیدا خواهد کرد.
استفاده از یادگیری عمیق برای بهبود رویههای جراحی
اریک توپول، متخصص قلب از مؤسسه پژوهشی اسکریپس آمریکا، میگوید: «پس از ۳۰ سال خواندن کاردیوگرام، هرگز نمیتوانم بگویم کاردیوگرامی که میبینم، مربوط به زن یا مرد است یا اینکه سن شخص را مشخص کنم. این در حالی است که ماشین میتواند تشخیص دهد که آیا فرد دچار کمخونی است، اختلال عملکرد عضله قلب دارد یا تشخیصهای دشواری مانند آمیلوئیدوز یا کاردیومیوپاتی هیپرتروفیک را انجام دهد.»
توپول نهتنها از توانایی ماشینها در تشخیص مشکلات بهتر از متخصصان، بلکه از اینکه میتوانند الگوهایی کشف کنند که کارشناسان متوجه آن نمیشوند هیجانزده است. او میگوید: «در ژاپن، به جای اعتماد به چشم متخصص گوارش، از دستگاهی برای برداشت پلیپها در زمان واقعی با استفاده از بینایی ماشین و تشخیص اینکه آیا ممکن است سرطانی باشند یا نه و اینکه آیا باید نمونهبرداری انجام شود یا نه، استفاده میشود. ماشینها جایگزین پزشکان نخواهند شد؛ اما پزشکانی که از هوش مصنوعی استفاده میکنند، بهزودی جایگزین کسانی میشوند که از آن استفاده نمیکنند.»
بااینحال، هنوز روزهای اولیه استفاده از هوش مصنوعی در زمینهی مراقبتهای بهداشتی است. پیرس کین، چشمپزشک مشاور در بیمارستان چشم مورفیلدز لندن، همکاری مورفیلدز و گروه سلامت دیپمایند گوگل را رهبری کرده است. او در سال ۲۰۱۸، مقالهی اثبات مفهومی در مجلهی Nature منتشر کرد که اولین تشخیص موفقیتآمیز هوش مصنوعی را برای بیماری چشم نشان میداد. کین میگوید: «... در همین حین، این مسئله کمی ناخوشایند است؛ زیرا واقعیت آن است که هنوز بینایی میلیونها نفر را نجات ندادهایم. ما در نیمه راه مسیر رسیدن به آن نقطه هستیم. الگوریتمی که توسعه دادیم، در حال حاضر استفادهی بالینی ندارد؛ بنابراین ما در تلاش برای تکمیل آن هستیم.»
کین به مطالعهی INSIGHT اشاره میکند که ارتباط بیماریهای چشم با وضعیتهای دیگری مانند دیابت و زوال عقل را مورد بررسی قرار میدهد. او میگوید: «ما از چشم بهعنوان دریچهای برای دیدن سایر بدن استفاده میکنیم. این ایدهای قدیمی است؛ اما با استفاده از یادگیری عمیق، اکنون میتوانیم به تصویری از شبکیه چشم نگاه کنیم و بگوییم: مربوط به زنی ۵۸ ساله است که سیگاری نیست و دیابت ندارد، شاخص توده بدنی او حدود ۲۵ درصد و فشار خون حدود ۱۵۰ روی ۸۵ است. برای من، این حیرتآور است.»
مطالعهی INSIGHT در حال تجزیهوتحلیل بیش از سه میلیون اسکن توموگرافی انسجام نوری (OCT) از حدود ۳۰۰ هزار بیمار در بیمارستان مورفیلدز است که طی دورهی ۴۰ ساله گرفته شده. کین میگوید: «ما اکنون برای افرادی که در مورفیلدز دارای اسکن شبکیه هستند، میدانیم کدام یک دچار حمله قلبی، آلزایمر یا دیگر علل زوال شده است. علت هیجان ما آن است که فکر میکنیم اگر بتوانیم دادههای مناسبی جمع کنیم، با استفاده از یادگیری عمیق، خواهیم توانست اطلاعات بیشتری در مورد سلامت سایر اعضای بدن پیدا کنیم.»
هوش مصنوعی بر بیماران نیز تأثیر میگذارد و به آنها کمک میکند سلامتی خود را مدیریت کنند و مشکلات سلامتی خود را تشخیص دهند. اپل در سال ۲۰۱۸، اولین الگوریتم یادگیری عمیق مورد تأیید سازمان غذا و دارو را برای مصرفکنندگان بهمنظور تشخیص فیبریلاسیون دهلیزی از طریق ساعت هوشمند اپل ساخت. کاربردهای دیگر هوش مصنوعی در زمینهی خودتشخیصی عفونت دستگاه ادراری، سرطان پوست و عفونت گوش است. توپول میگوید: «کاربرد هوش مصنوعی برای مراقبتهای بهداشتی و پزشکی فقط دقت نیست؛ بلکه صحت نیز هست. ما میخواهیم پزشکی داشته باشیم که اشتباهات کمتری داشته باشد؛ اما این همهی آن نیست.»
از نظر توپول، مهمترین جنبه آن است که هوش مصنوعی بتواند ارتباط انسانی پزشک و بیمار را تقویت کند. او میگوید: «پزشکان بیمار را به مدت بسیار کوتاهی میبینند و این کافی نیست. شما به زمان نیاز دارید که هوش مصنوعی میتواند آن را به شما هدیه کند تا افراد اینقدر احساس فشار نکنند.» آنچه توپول میخواهد، آن است که پزشکان زمان بیشتری با بیمار بگذرانند. برای مثال، با پردازش زبان طبیعی میتوان مکالمات را ثبت و رونویسی کرد و به پزشکان اجازه داد به جای نگاه کردن به صفحهکلید، زمان بیشتری صرف مشاهدهی بیمار کنند.

در این مقاله نحوهی ساخت تصاویر اکشن فیگور با چت جی پی تی را یاد میگیرید. دو پرامپت مفید هم برای شروع کار در اختیار خواهید داشت.

هزینه رجیستری آیفون با توجه به نوع واردات با رویهی تجاری یا مسافری، متفاوت است. در این مقاله نحوه محاسبه هزینه رجیستری آیفون را آموزش میدهیم.

مطالعهای جدید نشان میدهد توانایی شناختی کلاغها به قدری خوب است که بتوانند اشکال مختلف هندسی را بدون هیچ آموزش قبلی، از یکدیگر تشخیص دهند.

برای رصد فعالیتهای ورزشی و ازدستندادن تماسها و کنترل راحتتر گوشی، در این راهنمای خرید ساعت هوشمند سراغ بهترین گزینههای موجود در بازار رفتهایم.

واقعیت دربارهی تولید آیفون در آمریکا چیزی فراتر از تصمیم سیاسی است؛ چرا حتی اپل هم نمیتواند این رؤیا را عملی کند؟

سامسونگ سرانجام ابزار Good Lock را برای کاربران سرتاسر جهان منتشر کرد؛ ابزاری که امکانات شخصیسازی بسیار زیادی برای گوشیهای گلکسی ارائه میدهد.

در یک سال گذشته بسیاری از زنان در اصفهان بدون خودرو، بارها پیامکهای تذکر حجاب دریافت کردهاند. این سیستم نظارتی چگونه کار میکند؟




