بازیابی بینایی یک مرد نابینا به کمک ژنهای جلبک
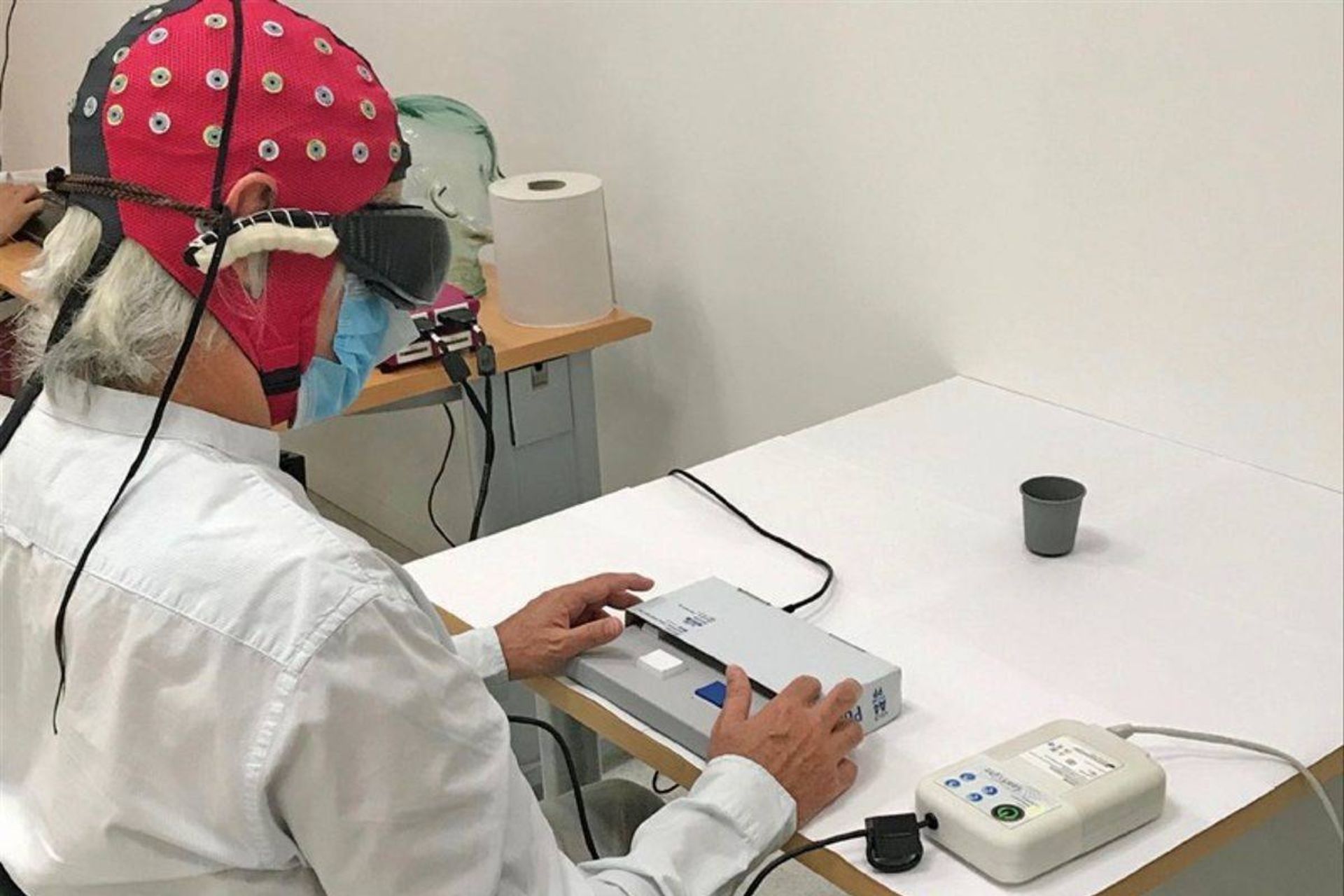
جایی در پاریس، در اتاقی سفید، مردی نشسته پشت میز سفیدی با دستگاهی شبیه هدست واقعیت مجازی، دست راست خود را دراز کرد و انگشتان خود را روی دفترچهای سیاهرنگ گذاشت. این حرکت ساده که او آن را با اطمینان انجام داد، به علت بسیار مهمی قابل توجه بود: مرد نزدیک به چهار دهه نابینا بود. چیزی که اکنون فرق میکرد، آن بود که بهعنوان بخشی از کارآزمایی بالینی، ژنهایی درون یکی از چشمهای او تزریق و موجب شده بود نورونهای شبکیهی او پروتئین حسکنندهی نوری را تولید کنند که بهطور طبیعی در جلبک سبز یافت میشود.
وقتی عینک سیاهی که او به چشم زده بود، تصاویر ویدئویی محیط پیرامون مرد نابینا را بهعنوان پرتو نور پالسی به سلولهای اکنون حساس به نور او رساند، نورونها شلیک شدند و سیگنال از طریق عصب بینایی به مرکز پردازش بینایی مغز منتقل شد. نورونهای اصلاحشده ژنتیکی جایگزین گیرندههای نوری شدند که او سالها پیش به علت نوعی بیماری ژنتیکی به نام رتینیت پیگمانتر از دست داده بود. پیشرفت این مرد در شناسایی اشیاء داخل آزمایشگاه و در فضای بیرون در مجلهی Nature Medicine گزارش شد.
مرد نابینا نمیتوانست رنگها یا جزئیات ریز را ببیند؛ اما مطالعهی موردی حاضر، اولین تلاشی است که در آن از درمان اپتوژنتیک با موفقیت برای بازگردان دید جزئی به بیماری نابینا استفاده میشود. خوزه آلن ساهل از دانشگاه پیتسبورگ آمریکا و دانشگاه سوربن فرانسه، چشمپزشک و نویسندهی مطالعه، از مطالعهی خود بهعنوان نقطه عطف مهمی یاد کرد.
به گزارش استت نیوز، ساهل و همکارانش از سال ۲۰۱۰ در بازل سوئیس آزمایش رویکرد اپتوژنتیک را برای درمان رتینیت پیگمانتر در موشها آغاز و چند سال پیش، شرکتی با عنوان GenSight Biologics برای توسعه بیشتر درمان و انجام کارآزماییهای بالینی تأسیس کردند. آنها از سال ۲۰۱۸ اقدام به ثبت نام بیمارانی برای کارآزمایی ایمنی مرحلهی اول در پاریس، لندن و پیتسبورگ کردند و مردی که در مطالعه توصیف شده است، اولین شرکتکننده بود. ساهل میگوید: «قطعا مطالعات بسیاری طی ۱۳ سال گذشته انجام شده است، اما اینکه بتوانیم اولین افرادی باشیم که نشان بدهیم فناوری اپتوژنتیک میتواند در انسان مؤثر باشد، برای ما بسیار هیجانانگیز است.»
رتینیت پیگمانتر اصطلاحی کلی برای گروه متنوعی از بیماریهای ارثی پیشرونده است که براثر وقوع جهش در دهها ژن مختلف ایجاد میشود. این جهشها موجب میشوند سلولهای گیرنده نوری شبکیه که سلولهای استوانهای و مخروطی نام دارند، از بین بروند و درنهایت به نابینایی کامل منجر میشود. این بیماری بیش از دو میلیون نفر را در سراسر جهان مبتلا کرده است و برای بیشتر آنها درمانی وجود ندارد.
اولین ژندرمانی مورد تأیید سازمان غذا و داروی آمریکا برای درمان بیماری چشمی، لوکستورنا نام دارد که شامل استفاده از ناقلی ویروسی برای رساندن نسخهی فعالی از ژن RPE65 است؛ اما کمتر از ۵ درصد از بیماران مبتلا به رتینیت پیگمانتر حامل این جهش خاص هستند. به این ترتیب، برای بیشتر بیماران فقط یک گزینه درمانی باقی میماند: ریزتراشهای تهاجمی که روی شبکیه کاشته میشود و از دوربین ویدئویی نصبشده روی عینک برای تحریک سلولهای گیرندهی نوری که هنوز به مغز متصل هستند، استفاده میکند.
دستگاه مذکور که آرگوس دو (Argus II) نام دارد، اگرچه در سال ۲۰۱۳ تأیید شد، نتوانست چیزی بیش از نسخهای پیکسلدار از واقعیت را بازیابی کند و تا سال ۲۰۱۹، فقط ۳۵۰ بیمار در سراسر جهان این پروتز دریافت را کردند. تاد دورهام، معاون پژوهشهای بالینی بنیاد مبارزه با نابینایی که سازمانی است که با حمایت از بیماران تأسیس شده، میگوید:
در حال حاضر برای کسانی که مبتلا به رتینیت پیگمانتر تشخیص داده میشوند، امید زیادی وجود ندارد. وقتی این افراد قدرت بینایی خود را از دست بدهند، بخش زیادی از استقلال خود را از دست میدهند و این امر، بار سلامت روان قابل توجهی به همراه خواهد داشت. اینها شرایط بسیار تأثیرگذاری هستند.
به گفتهی دورهام، اپتوژنتیک روش درمانی مهمی است، زیرا برخلاف ایمپلنتها و ژندرمانی این توانایی را دارد که به افرادی که تمام عملکرد گیرندههای نوری خود را از دست دادهاند، کمک کند. این تکنیک که در سال ۲۰۰۵ ابداع شد، شامل وارد کردن DNA به نورونها است تا در برابر نور خاصی واکنش بدهند و نیز شامل روشی برای تاباندن نور به نورونها برای روشن و خاموش کردن آنها است. رویکرد اپتوژنتیک در موشهای آزمایشگاهی اغلب شامل اتصال مستقیم فیبرهای نوری به مغز جوندگان برای مطالعهی مواردی مانند تشخیص بو، پردازش شنیداری و اعتیاد است.
برای مطالعهی جدید، پژوهشگران به یکی از چشمهای بیمار ۵۸ سالهای، وکتور وابسته به آدنوویروسی تزریق کردند که حامل دستورالعملهای ژنتیکی ساخت پروتئینی به نام ChrimsonR بود. وقتی نور کهرباییرنگ به پروتئین حاصل برخورد میکند، پروتئین تغییر شکل پیدا میکند و به یونها اجازه میدهد در سلولها جریان پیدا کنند و وارد و خارج شوند. این ناقل سلولهای گانگلیونی شبکیه را هدف قرار میدهد که در چشم سالم سیگنالها را از سلولهای مخروطی و استوانهای جمعآوری میکنند و اطلاعات حاصل را به قشر بینایی مغز میفرستد. حتی در بیماران مبتلا به رتینیت پیگمانتر پیشرفته، این سلولهای گانگلیونی هنوز زنده هستند اما کاری انجام نمیدهند؛ زیرا اطلاعاتی به آنها نمیرسد. افزودن ChrimsonR به سلولهای مذکور موجب میشود بتوانند نور را احساس کنند.
ساهل و همکارانشان قبلاً پروتئین متفاوتی را آزمایش کرده بودند که با نور آبیسبز فعال میشد و روش آنها در موش بسیار کارآمد بود؛ اما این انتهای طیف بینایی بسیار پرانرژی است و وقتی آن را در نخستیها آزمایش کردند، با مشکلاتی مواجه شدند.
در شبکیه طبیعی چشم پستانداران، یک پروتئین حسکننده نور پروتئین دیگر را فعال میکند و پروتئین دوم نیز به نوبهی خود پروتئین بعدی را فعال میکند و به این ترتیب، طی روندی آبشاری سیگنال را تقویت میکنند. در این حالت، یک پروتئین میتواند تا یک میلیون کانال یونی را باز کند. این در حالی است که در روش اپتوژنتیک، یک پروتئین معادل یک کانال است، بنابراین دانشمندان باید سیگنال را به روشی دیگر یعنی از طریق افزودن نور بیشتر تقویت کنند. عینک به همین منظور استفاده میشود، اما نور آبیسبز بسیار زیاد میتواند برای سلولهای باقیمانده سمی باشد (دلیل آنکه نباید مستقیما به خورشید خیره شوید).
پژوهشگران با استفاده از پروتئین ChrimsonR و نور کهربایی توانستند تعادل مناسبی میان اثربخشی و ایمنی برقرار کنند. پل برنستین، چشمپزشک و متخصص شبکیه در دانشکده پزشکی دانشگاه یوتا که در مطالعه نقشی نداشت، میگوید: «این مطالعه قدمی کوچک اما قطعی در جهت نشان دادن این موضوع است که این روش در انسان کارآمد است.»
هدف کارآزمایی فعلی، تعیین دوز مناسب است؛ بنابراین بیمار گزارششده در مطالعه موردی به همراه دو بیمار دیگر پایینترین دوز را دریافت کردند. او اولین موردی بود که مقداری بازیابی بینایی را در فوریه ۲۰۲۰، پیش از وقوع دنیاگیری کووید ۱۹ گزارش کرد. سایر بیماران که ژندرمانی را دریافت کردند، نتوانستند برای آموزش با عینک و آزمایشهای آزمایشگاهی به بیمارستان برگردند. ساهل گفت آنها باید بتوانند این کار را بهزودی آغاز کنند زیرا شیوع کووید ۱۹ کاهش پیدا میکند. سه بیمار دیگر دوز متوسط را دریافت کردهاند و انتظار میرود سه بیمار هم بهزودی بالاترین دوز را دریافت کنند.
بیمار اول علاوه بر دفترچه یادداشت، میتوانست اشیاء دیگری مانند فنجانها و بطری کوچکی از مایع سبزرنگ را پیدا کند و تعداد آنها را نیز بشمارد. هرچه اجسام بزرگ و کنتراست بالاتر بود، قدرت تشخیص او بیشتر میشد. بیمار همچنین گزارش کرد که میتواند از بیرون خیابان خط عابر پیاده را ببیند و حتی تعداد خطوط سفید را بشمرد.
در جریان بخش آزمایش آزمایشگاهی، پژوهشگران از نوار مغزی (EEG) برای ثبت فعالیت عصبی در قشر بینایی مرد استفاده کردند که نشان داد فعال شدن ChrimsonR به مغز گسترش پیدا کرده بود. البته هیچیک از تغییرات فوری نبود. چهار تا شش ماه پس از تزریق طول کشید تا پروتئینها به مقدار کافی بیان شوند و چند ماه آموزش با عینک برای بیماران نیاز بود تا بتوانند پرتو نور را مستقیما به سلولهای بیانکنندهی پروتئین در شبکیه هدایت کنند. بیمار برای یافتن محل اشیاء، با استفاده از تمام سر خود منطقه را به سمت عقب و جلو اسکن میکرد. البته بینایی که به او بازگردانده شد، دنیایی دانهدانه از کنتراست سیاه و سفید بود. برای انجام کارهایی مانند خواندن یا تشخیص چهره با وضوح بسیار بالاتری نسبت به آنچه رویکرد اپتوژنتیک میتواند ارائه دهد، نیاز است.
بااینحال، برای پزشکانی نظیر برنستین که دههها مجبور بودهاند به بیشتر بیماران دچار رتینیت پیگمانتر خود بگویند هیچ روش درمان خوبی در دسترس نیست، این پیشرفتی خوشایند است. وی میگوید: «آنچه اکنون اتفاق میافتد، وقتی ۲۶ سال پیش شروع به کار کردم، در حد داستانهای علمیتخیلی بود.» او منتظر دادههای بیشتری از بیماران دیگر کارآزمایی است.
اما مطالعهی موردی جدید سیگنال دلگرمکنندهای را ارسال میکند مبنی بر اینکه افرادی مانند بیمار مورد مطالعه ممکن است بتوانند بخش بزرگی از جهان را که مدتها بود قادر به پیمایش آن نبودند، موقعیتیابی کند. برنستین میگوید: «این نوع رویکردهای پیشرفت،ه آنچه زمانی خیلی دور به نظر میرسید (بازگردان بینایی به این نوع بیماران)، بسیار نزدیکتر کرده است.»
در حال حاضر علاوه بر مطالعهی GenSight دو کارآزمایی بالینی دیگر در حال آزمایش استفاده از اپتوژنتیک برای درمان بیماریهای پیشرونده شبکیه هستند. اولین مطالعه که در سال ۲۰۱۵ آغاز شد، مبتنی بر یافتههای یکی از پیشگامان ناشناختهی اپتوژنتیک است که ژو هوآ پن نام دارد و در دانشگاه ایالتی وین مشغول به کار است. بر اساس گزارش این کارآزمایی، دوز دارو در اولین گروه از بیماران ایمن بوده؛ اما هنوز تأثیر آن را بر بینایی گزارش نکرده است. اخیرا نیز شرکتی به نام Bionic Sight شروع به استخدام بیمارانی برای مطالعهی خود کرده است که ژندرمانی را با عینک بیومتریک ترکیب میکند.