برای اولینبار کریسپر تزریقشده به خون نوعی بیماری ژنتیکی را درمان میکند

ویرایشگر ژن کریسپر در رفع جهشهای بیماری در سلولهای رشدیافته در آزمایشگاه عالی عمل میکند؛ اما استفاده از کریسپر برای درمان بیشتر افراد مبتلا به اختلالات ژنتیکی به رفع مانع بزرگی نیاز دارد: واردکردن قیچی مولکولی به بدن و استفاده از آن برای برش DNA در بافتهای موردنیاز.
بهگزارش ساینس، در نمونه بیسابقهای در علم پزشکی، پژوهشگران داروی کریسپری به خون افراد متولدشده با نوعی بیماری تزریق کردهاند؛ بیماریای که موجب بیماری قلب و اعصاب کشندهای میشود. پژوهشگران نشان دادند در سه مورد از آنها، این دارو تولید پروتئین سمی بهوسیله کبد را تقریبا متوقف کرد.
اگرچه هنوز خیلی زود است بگوییم درمان کریسپر علائم بیماری مذکور موسوم به آمیلوئیدوز ترانستیرتین را تسکین میدهد یا نه، نتایج مقدماتی هیجانی در زمینه امکان توسعه درمانی یکباره و مادامالعمر برای این نوع بیماریها ایجاد کرده است.
افزونبراین، پژوهش جدید نقطه عطفی در رقابت ایجاد درمانهای مبتنیبر RNA پیامرسان (mRNA)، یعنی دستورالعملهای ساخت پروتئین است که بهطور طبیعی سلولها آن را تولید میکنند. مولکول RNA پیامرسان مصنوعی اساس ساخت دو واکسن کووید ۱۹ بوده است که برای مبارزه با دنیاگیری ویروس کرونا به میلیونها نفر تزریق میشود و بسیاری از شرکتها مشغول کار روی دیگر واکسنها و داروهای mRNA هستند.
کنت چین، پژوهشگر بیماریهای قلبوعروق در مؤسسه کارولینسکا، یکی از همبنیانگذاران مدرنا و ازجمله سازندگان واکسنهای کووید ۱۹، درحال ساخت داروهای mRNA است. وی میگوید: «درمان جدید که شامل mRNA کدکننده یکی از دو جزء کریسپر است، آغازگر همگرایی میان حوزههای کریسپر و mRNA است.»
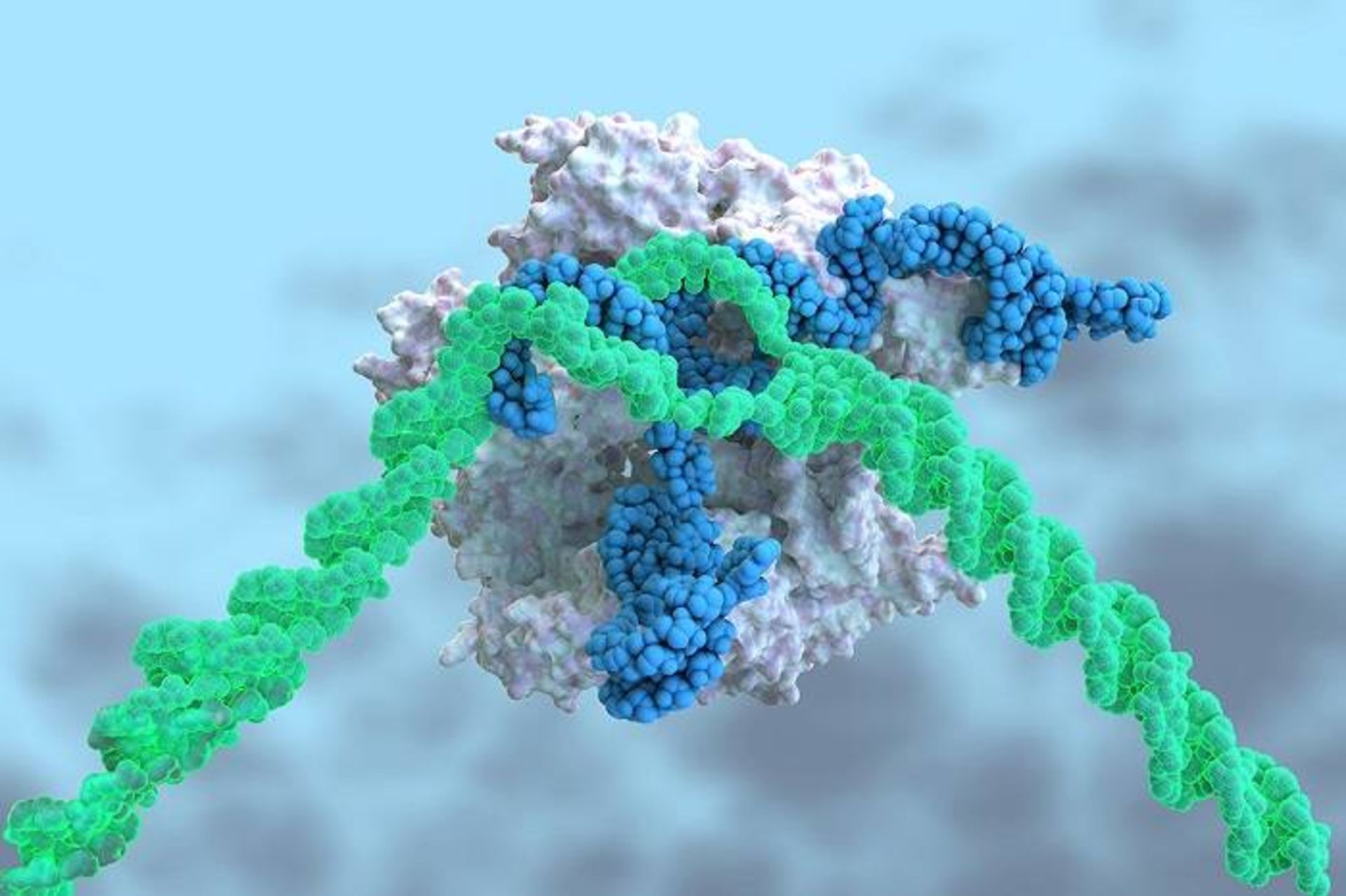
درمان جدید مبتنیبر کریسپر برای بیماری نادر و کشنده کبدی به تزریقی متکی است که RNA پیامرسان کدکننده آنزیم برشدهنده DNA (سفید) و نیز RNA دیگری (آبی) را شامل میشود که آن را بهسمت توالی ژن خاصی (سبز) هدایت میکند
هدف کارآزمایی بالینی کریسپر، غیرفعالکردن ژن جهشیافتهای است که موجب میشود سلولهای کبدی شکلی از ترانستیرتین را تولید کنند که تاخوردگیهای نادرستی دارد. این پروتئین در اعصاب و قلب جمع و به درد و بیحسی و بیماری قلبی منجر میشود.
بیماری حاصل نسبتا نادر است و داروی تأییدشده آن، یعنی پاتیسیران میتواند این وضعیت را تثبیت کند؛ اما پژوهشگران شرکت ریجنران و استارتاپ اینتلی تراپیوتیکس بیماری مذکور را بهعنوان اثبات مفهوم خوبی برای نشاندادن قابلیت درمان کریسپر تزریقی دیدند که در حال ایجاد آن بودند.
سال گذشته، پژوهشگران از کریسپر برای فعالکردن فرم جنینی از هموگلوبین استفاده کردند تا بیماری سلول داسی یا بیماری مرتبطی را در چند نفر اصلاح کنند. این درمان به برداشتن سلولهای بنیادی خون بیمار و اصلاح آنها با استفاده از کریسپر در ظرف آزمایشگاه و سپس واردکردن مجدد آنها به بدن بیمار نیاز داشت. همچنین، کارآزمایی دیگری برای آزمایش تزریق مستقیم ویروسی به چشم درحال انجام است که کدکننده اجزای کریسپر است.
درمان بیشتر بیماریهای دیگر بهمعنای تزریق اجزای کریسپر یا دستورالعملهای ژنتیکی آنها به خون و واداشتن درمان برای هدف قراردادن بافت یا ارگانی خاص است که مشکل بزرگی محسوب میشود؛ اما بهطور بالقوه در کبد راحتتر انجام میشود؛ زیرا این ارگان ذرات خارجی را حذف میکند. در کارآزمایی کریسپر، به چهار مرد و دو زن مبتلا به آمیلوئیدوز ترانستیرتین ۴۶ تا ۶۴ ساله ذرات لیپیدی حامل دو RNA مختلف تزریق شد: mRNA کدکننده پروتئین Cas که جزئی از کریسپر است و DNA را برش میدهد و RNA راهنما که آن را بهسوی ژن کدکننده TTR (ترانستیرتین) هدایت میکند. پس از اینکه Cas برش خود را ایجاد کرد، ماشینآلات ترمیم DNA شکستگی را بهصورت ناقص ترمیم میکنند و فعالیت ژن مختل میشود.
پژوهشگران در مجله The New England Journal of Medicine گزارش کردند پس از ۲۸ روز، سه مرد که بیش از دو دُز درمان را دریافت کرده بودند، ۸۰ تا ۹۶ درصد کاهش در سطوح TTR را نشان دادند که در حد یا بهتر از ۸۱ درصدی بود که بهطور متوسط با مصرف پاتیسیران حاصل میشد. دیوید آدامز، عصبشناس دانشگاه پاریسساکلی، کارآزمایی پاتیسیران را سرپرستی کرده است. وی میگوید: «این میتواند بهطور بالقوه اولین درمان دائم برای این بیماری توارثی ناتوانکننده و تهدیدکننده زندگی باشد. داروی پاتیسیران نوعی RNA است که تولید TTR را موقتا سرکوب میکند؛ بنابراین، باید بهطور منظم تزریق شود.»
ممکن است ماهها طول بکشد تا بیماران دریافتکننده درمان کریسپر شاهد کاهش علائم خود باشند؛ اما آنها عوارض جانبی کوتاهمدت کمتری را گزارش کردند. البته مشکلاتی وجود دارد که میتواند با گذشت زمان ظاهر شود. برای مثال، کریسپر بهطور بالقوه ممکن است به برشهایی در مکان اشتباه DNA و در سلولهای غیرکبدی و بروز سرطان یا مشکلات دیگر منجر شود.
بااینهمه، رویکرد mRNA محصور در لیپید بهطور بالقوه ایمنتر از استفاده از ویروسها برای حمل دستورالعملهای ژنتیکی کدکننده پروتئین ویرایشکننده و RNA راهنما درون سلولها است. این ژنها میتوانند در سلولها باقی بمانند و تا مدتها پس از انجام وظیفه به تولید ویرایشگر ژن ادامه دهند. درمقابل، مزیت mRNA در این است که پس از انجام وظیفه از بین میرود.
مطالعه جدید راه را برای درمان بیماریهای کبدی دیگر با استفاده از کریسپر یا ازطریق غیرفعالکردن ژن یا اصلاح آن با کمک الگوی DNA هموارتر میکند. روش دوم نیز میتواند برای تبدیل کبد به کارخانه تولید آنزیمهایی استفاده شود که در بخشهای دیگر بدن نیاز است.
جنیفر دودنا از دانشگاه کالیفرنیا در برکلی سال گذشته بههمراه امانوئل شارپنتیه به پاس کشف کریسپر جایزه نوبل را دریافت کرد و همبنیانگذار اینتلی است. وی چشماندازهای وسیعتری را میبیند و میگوید: «پژوهش جدید قدم اول و مهمی در مسیر دستیابی به توانایی غیرفعالسازی یا ترمیم یا جایگزینی هر ژنی است که در هر نقطه از بدن موجب بیماری میشود.»