جدول تناوبی مندلیف تا کجا ادامه خواهد داشت؟

از دههی ۱۹۳۰ بود که فیزیکدانها موفق شدند دهها عنصر جدید شیمیایی را شناسایی کنند. اما سؤال اینجا است که آیا این کشفیات قرار است تا همیشه ادامه پیدا کنند؟
در ۳۰ دسامبر ۲۰۱۵ دقیقا ۴ عنصر جدید بهطور رسمی وارد دنیای شیمی شد. اتحادیهی بینالمللی شیمی محض و کاربردی (آیوپاک) ساخت ۴ عنصر جدیدی را که در محیط آزمایشگاهی تولید شده بودند را تأیید کرد.
بعضی از گزارشها حاکی از آن است که این عنصرها روند تناوبی جدول تناوبی را تکمیل کرده و به پایان میرساند. هر چند که این ادعا اشتباه است. چرا که پس از اتمام آخرین دسته از عنصرها باز هم میتوانید با اطمینان خاطر منتظر ساخت عنصرهای بیشتری باشید. با این حال روند کشف این عنصرها سختتر بوده و مستلزم زمان بیشتری است.
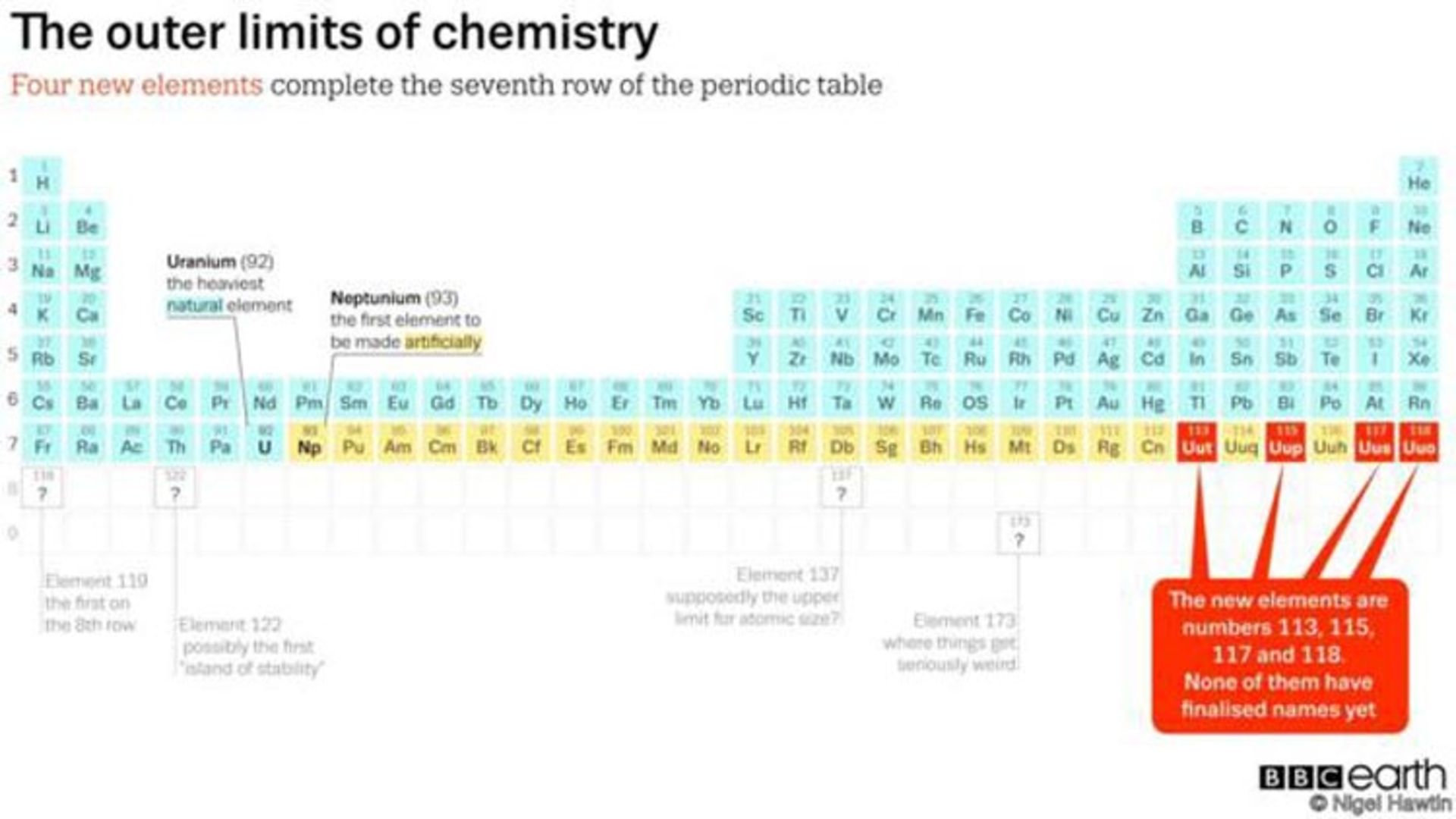
این عنصرهای جدید ساخته شده ردیف هفتم جدول تناوبی را تکمیل کردهاند. چنانچه عنصرهایی با اعداد اتمی ۱۱۹ یا ۱۲۰ ساخته شوند، ردیف بعدی در جدول، شکل خواهد گرفت.
هیچ کس نمیداند که عنصرهای جدید تا کجا این جدول را ادامه خواهند داد. بعضی گمانهزنیها محدودیتی برای این گستردگی قائل نمیشوند. برخی دیگر هم این نکته را مد نظر قرار میدهند که عنصرها حجم محدودی از اتمها را میتوانند تحمل کنند و چنانچه عنصری از تعداد اتم بالایی برخوردار شود، ناپایدار شده و در اثر آشفتگی رادیواکتیویته از هم پاشیده خواهد شد.
با این حال واضح است که حتی اگر دست به ساخت عنصرهایی بزنیم که روند سنگینتر شدن را طی میکنند، راهکارهایی برای جلوگیری از فروپاشی آنها هم پیدا خواهیم کرد.

مقدمهای دربارهی عنصرها
عنصرها، بلوکهای اساسی در دنیای شیمی هستند. در واقع هر عنصر به تنهایی مادهای است که تنها شامل یک نوع خاص از اتم میشود. از این رو ساخت عنصر جدید به معنای ایجاد نوع جدیدی از اتم است.
هر عنصر عدد اتمی خاص خود را دارد. به عنوان مثال عدد اتمی کربن ۶ است. عدد اتمی یک مقدار یا برچسب قراردادی نیست و اهمیت اساسی در شناسایی ویژگیهای عنصر دارد. این عدد تعداد پروتونها، نوع ذرات و ظرفیت تعداد اتمها را مشخص میکند.
پروتونها ذراتی با بار الکتریکی مثبت هستند که در مرکز اتم تجمع پیدا کردهاند. در مقابل، الکترونها ذرات بسیار سبکتری هستند که با داشتن بار منفی تعادل را با پروتون برقرار ساخته و به صورت ابر الکترونی به دور هسته میچرخند.
به غیر از اتمهای هیدروژن، هستههای اتمی باقی عنصرها حاوی نوع دیگری از ذرات به نام نوترون هستند که جرم آنها تقریبا معادل پروتون بوده و فاقد بار الکتریکی هستند. اتمهای یک عنصر میتوانند تعداد نوترونهای متفاوتی داشته باشند و براساس این تفاوت در تعداد نوترون، ایزوتوپ نامیده میشوند. نوترونها در اتم نقش نوعی چسب را ایفا میکنند تا پروتونها را به هم پیوند دهند. بدون وجود نوترونها، بارهای الکتریکی مثبت پروتونها باعث ایجاد نوعی دافعه میشوند.
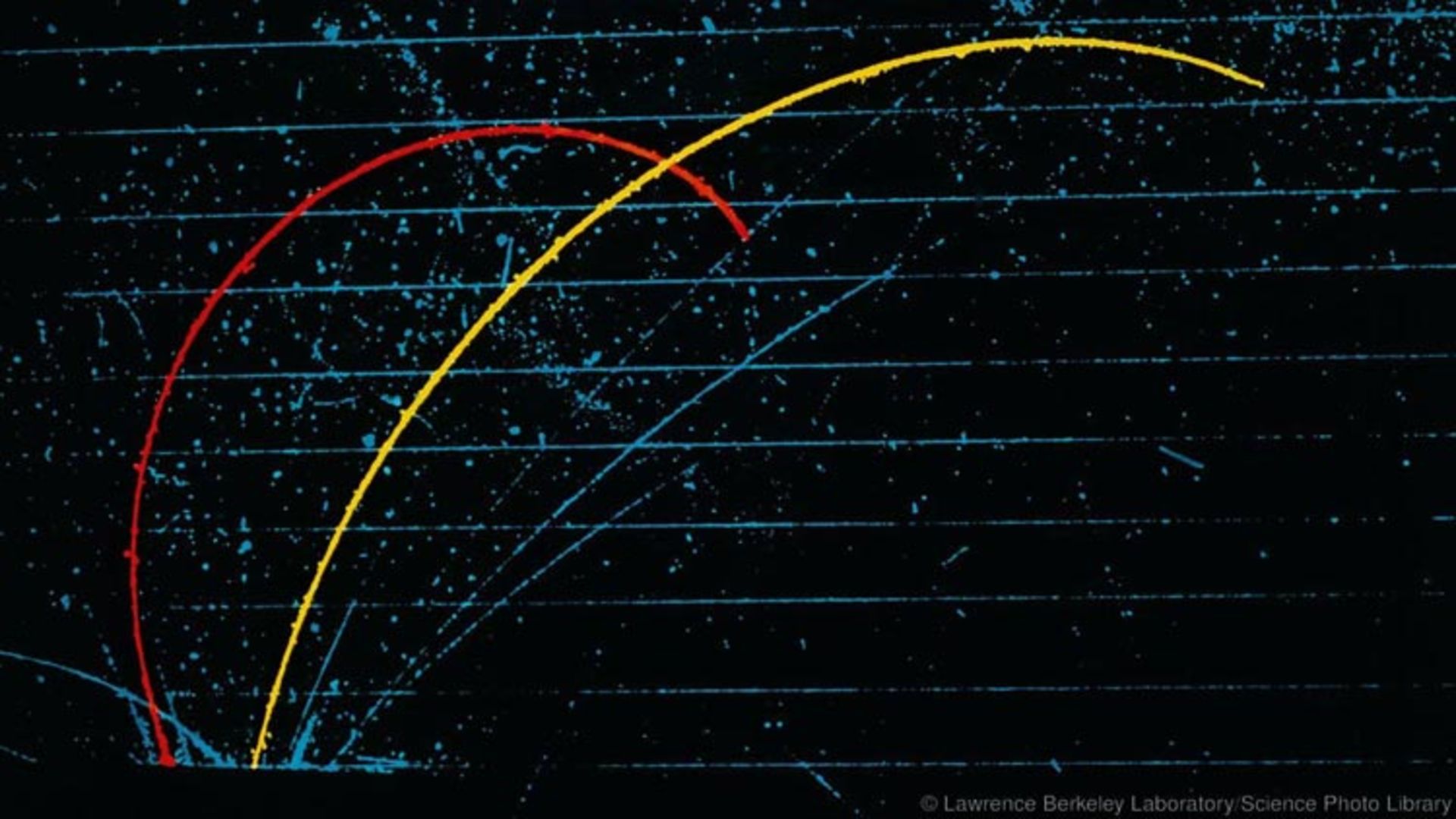
اتمهای فوق سنگین
با این وجود، در هستهی اتمهای بسیار سنگین مانند اورانیوم، پروتونها حتی با وجود نوترونها نمیتوانند بر دافعهی متقابل خود غلبه کنند. از این رو این نوع اتمها دچار فرآیندی به نام "تجزیهی رادیواکتیو" شده که باعث واپاشی ذرات و انرژی آنها خواهد شد.
هنگامی که یک اتم دچار واپاشی میشود، تعداد پروتونهای موجود در هستهی آن تغییر پیدا میکند. از این رو فروپاشی رادیواکتیو میتواند یک عنصر را به عنصر دیگری تبدیل کند. شاید این موضوع کمی عجیب و غریب به نظر برسد اما در واقعیت این پدیده دائم در حال رخ دادن است. حتی خیلی از اتمهای موجود در بدن ما هم این فرایند را تجربه میکنند.
هر هستهی اتمی دارای نسبت بهینهای از الکترونها و پروتونها است. بنابراین حتی اگر اتمی کوچک باشد اما تعداد نوترونها در آن کمتر یا بیشتر از حد لازم باشد، این اتم دچار واپاشی و تجزیه خواهد شد.
برای عنصرهای سبکی مانند کربن و اکسیژن این نسبت پایدار ۱:۱ است. در مقابل عنصرهای سنگینتر به نوترون بیشتری نیاز دارند.
فرآیندهای طبیعی جهان تنها میتوانند عنصرها را با وزن خاصی تولید کنند. هیدروژن، هلیوم، لیتیوم، بریلیوم و بور سبکترین عنصرهای جدول تناوبی بودند که در انفجار بزرگ (بیگ بنگ) ایجاد شدند. باقی عنصرهایی که سنگینتر بودند در فضای داخل ستارهها شکل گرفتند. شرایط دما و فشار بالا در این محیطها باعث درهم آمیختگی عنصرها به یکدیگر شد. از این پدیده به عنوان "همجوشی هستهای" یاد میشود. ستارههای بزرگتر میتوانند عنصرهای سنگینی مانند جیوه تولید کنند که تعداد پروتونهای هستهی آنها به ۸۰ میرسد.
با این حال بسیاری از عنصرهای موجود در جدول تناوبی حاصل انفجار ستارهای "ابرنواختر" (supernova) هستند. انرژیهای عظیم حاصل از این نوع انفجارها میتواند انواع جدیدی از همجوشیهای اتمی را تولید کند که منجر به ساخت عنصرهای سنگینی مانند اورانیوم با ۹۲ پروتون در هسته میشود.
از آنجا که هستههای اتمی با بار مثبت یکدیگر را دفع میکنند برای برقراری این همجوشی به مقادیر زیادی انرژی نیاز است. یک هسته برای ادغام با هستهی دیگر باید سرعت بسیار زیادی داشته باشد تا بتواند سد اتصال را بشکند.
به عنوان یک نتیجه، اورانیوم سنگینترین عنصر موجود در جهان است که در مقادیر قابل توجهی وجود دارد. تاکنون هیچ فرایند طبیعی نتوانسته عنصری سنگینتر از اورانیوم را بسازد.
از این رو وقتی دانشمندان سعی در ساخت عنصرهای جدید دارند، از شتابدهندههایی استفاده میکنند که بتواند یک دهم سرعت نور را فراهم کند.

رقابت برای ساخت عنصرهای جدید
در سال ۱۹۳۹ بود که اولین آزمایش در این زمینه صورت گرفت. دانشمندان، حین کار در دانشگاه کالیفرنیا در برکلی عنصری با عدد اتمی ۹۳ ساختند که اکنون با نام "نپتونیوم" در جدول تناوبی شناخته شده است.
دو سال بعد، همین تیم تحقیقاتی با بمباران عنصر اورانیوم با هستهی "هیدروژن سنگین"، به عنصری با عدد اتمی ۹۴ دست یافتند که اکنون با نام "پلوتونیوم" در جدول تناوبی وجود دارد.
آنها بهزودی متوجه شدند که عنصر پلوتونیوم هم مانند اورانیوم میتواند خود به خود طی یک فرایند "شکافت هستهای" دچار واپاشی شود. هستهی عظیم این عنصر در این فرایند به دو نیم تقسیم شده و مقدار بسیار زیادی انرژی آزاد میکند.
این یافته به سرعت مورد استفاده قرار گرفت. بهطوریکه در اوت ۱۹۴۵ بود که پلوتونیوم ساخته شده در بمب هستهای "فت من" (Fat Man) به کار برده شد و شهر ناکازاکی ژاپن بمباران شد. تا مدتها بعد از جنگ جهانی دوم، کشف پلوتونیوم به عنوان یک راز نظامی باقی ماند.
پس از پایان جنگ، فیزیکدانان تلاش جدید خود را برای ساخت عنصرهای جدید شروع کردند.

در طول چند دهه، برکلی، مرکز اصلی ایالات متحده آمریکا در تحقیقات مربوط به این زمینه بود، اما امروزه، بسیاری از این فعالیتها در ۴۰ کیلومتری آزمایشگاه ملی لارنس لیورمور صورت میگیرد. در سال ۱۹۵۶ هم روسها اقدام به برپایی مؤسسهی تحقیقات مشترک هستهای دوبنا (JINR) در مسکو کردند.
در ابتدا آمریکاییها پیشتاز این بازی بودند. بهطوریکه سه عنصر سنتز شده با اعداد اتمی ۹۵، ۹۷ و ۹۸ به نامهای آمریکیوم، برکلیم و کالیفرنیم شناخته شد.
عنصرهای جدید بعدی طی راههای کاملا متفاوتی ساخته شد. در دههی ۱۹۵۰ بود که آنها از بقایای موجود از آزمایشهای بمبهای هیدروژنی در آمریکا شناسایی شدند. این عنصرها، ناشی از همجوشیهای شکل گرفته حاصل از انفجار اورانیوم شکل گرفته بودند.
این بار دیگر از اسم مکانها برای نامگذاری عنصرها استفاده نشد و نام چهرههای برجسته مورد توجه قرار گرفت. برای مثال عنصر "انشتانیم" از نام "آلبرت انیشتین و "فرمیم" از نام "انریکو فرمی" اقتباس شد.
با اوج گرفتن جنگ سرد بین آمریکا و شوروی، رقابت در این زمینه بین دو کشور بالا گرفت. مابین اواخر دههی ۱۹۵۰ و اوایل دههی ۱۹۷۰ بود که بین تیم برکلی JINR اختلافی صورت گرفت. هر دو گروه ادعا داشتند که آنها عنصرهای ۱۰۲، ۱۰۴، ۱۰۵ و ۱۰۶ جدول تناوبی را ساختهاند. آیوپاک داوری این دعوا را به عهده گرفت و سرانجام در سال ۱۹۹۷ جایزهی ساخت"رادرفوردیوم" (عنصر ۱۰۴) را به تیم برکلی و جایزهی ساخت عنصر "دوبنیوم" (عنصر ۱۰۵) را به JINR اعطا کرد.
از طرفی دعوای مشابه دیگری بین JINR و آزمایشگاه تحقیقاتی یونهای سنگین با نام اختصاری (GSI) واقع در دارمشتات آلمان بر سر عنصر ۱۰۷ صورت گرفت. در نهایت اعتبار این کشف بین هر دو گروه تقسیم شد.
درحالیکه اوایل روش کار ساخت عنصرهای مصنوعی به این صورت بود که برای ساخت عنصر جدید، از بمباران اتمهای سنگین توسط اتمهای سبکتر استفاده شود، آزمایشگاه GSI راهکار جدیدی را انتخاب کرد. به عنوان مثال GSI توانست با شلیک یونهایی چون روی، نیکل و کروم روی هدفهای سرب و بیسموت، دو اتم با هستهی متوسط را با هم ادغام کند. بدین وسیله، عنصر ۱۰۸ با نام "هاسیم" برای اولین بار در GSI ساخته شد.
این روزها ساخت عنصرها کمی مشارکتیتر انجام میشود. بهطوریکه وقتی موضوع ساخت ۴ عنصر جدید مطرح شد، آمریکاییها، روسها و آلمانیها منابع خود را به اشتراک گذاشتند.
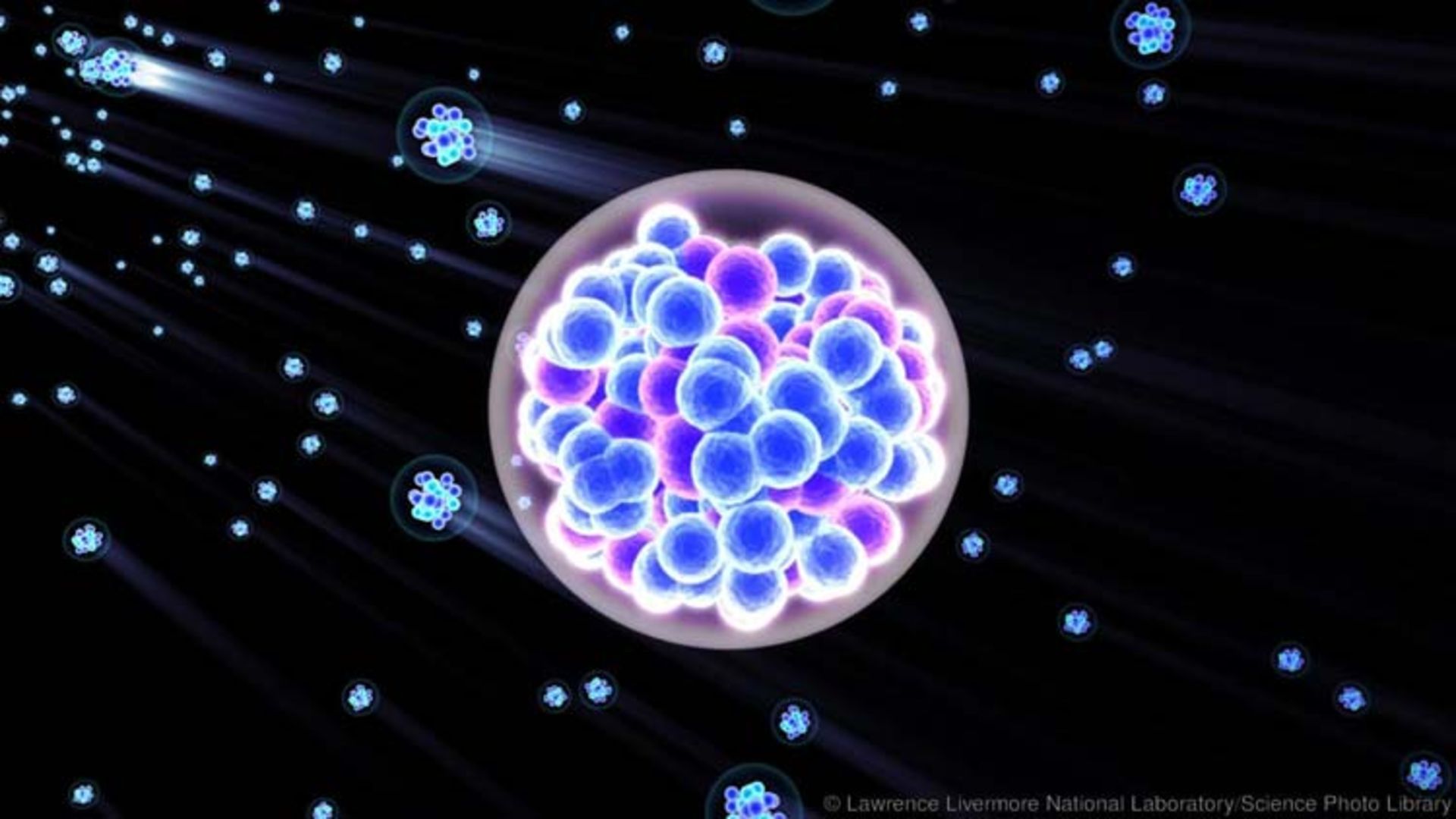
آیوپاک در این خصوص میگوید: "اولین سنتز قانعکننده که مربوط به ساخت عنصرهای ۱۱۵ و ۱۱۷ بود، با همکاری مشترک JINR و آزمایشگاه ملی اوک ریج در تنسی و لیورمور بین سالهای ۲۰۱۰ و ۲۰۱۲ انجام شد. همکاری جداگانهی لیورمور با JINR هم منجر به ساخت عنصر ۱۱۸ شد.
با این وجود، باز هم روسها از این که جایزهی ساخت عنصر ۱۱۳ به تیم ژاپنی ریکن (RIKEN) در شهر سایتاما اختصاص یافت ناراضی هستند. ضمن این که ممکن است نام "ژاپنیکیوم" به این عنصر نسبت داده شود.
روسها ادعا میکنند که این عنصر نخستین بار در سال ۲۰۰۳ با تصادم دو عنصر کلسیم بر آمریکیوم در مؤسسهی JINR ساخته شد و ژاپنیها یک سال بعد با شلیک یون روی بیسموت به آن رسیدند.
هر چند که کارشناسان آیوپاک در حال بررسی این اختلاف هستند اما هنوز به نتیجهی روشنی دست پیدا نکردهاند.
در ابتدا که عنصرهای جدید ساخته میشوند، همه دارای یک نوع اتم هستند اما پس از مدتی دچار واپاشی رادیواکتیو میشوند. از آنجا که ایزوتوپهای هر عنصر روند واپاشی متفاوتی دارند، هر کدام با نرخ مختلفی تجزیه میشوند. ضمن این که نیمه عمر آنها هم با یکدیگر فرق دارد. از این رو قضاوت در مورد این که ادعای کدام گروه درست است، کار راحت و سادهای نیست.
پوستهها و الکترونها
با این حال ممکن است اینطور به نظر برسد که در گسترش جدول تناوبی با محدودیت اندازهی اتمی مواجه باشیم. درحالیکه هنوز دلیل خوبی برای افزودن ردیف هشتم جدول تناوبی داریم. چرا که چشمانداز ردیف جدید به علت رویارویی با عنصرهای متفاوت با دیگر عنصرها از جذابیت بالایی برخوردار است.
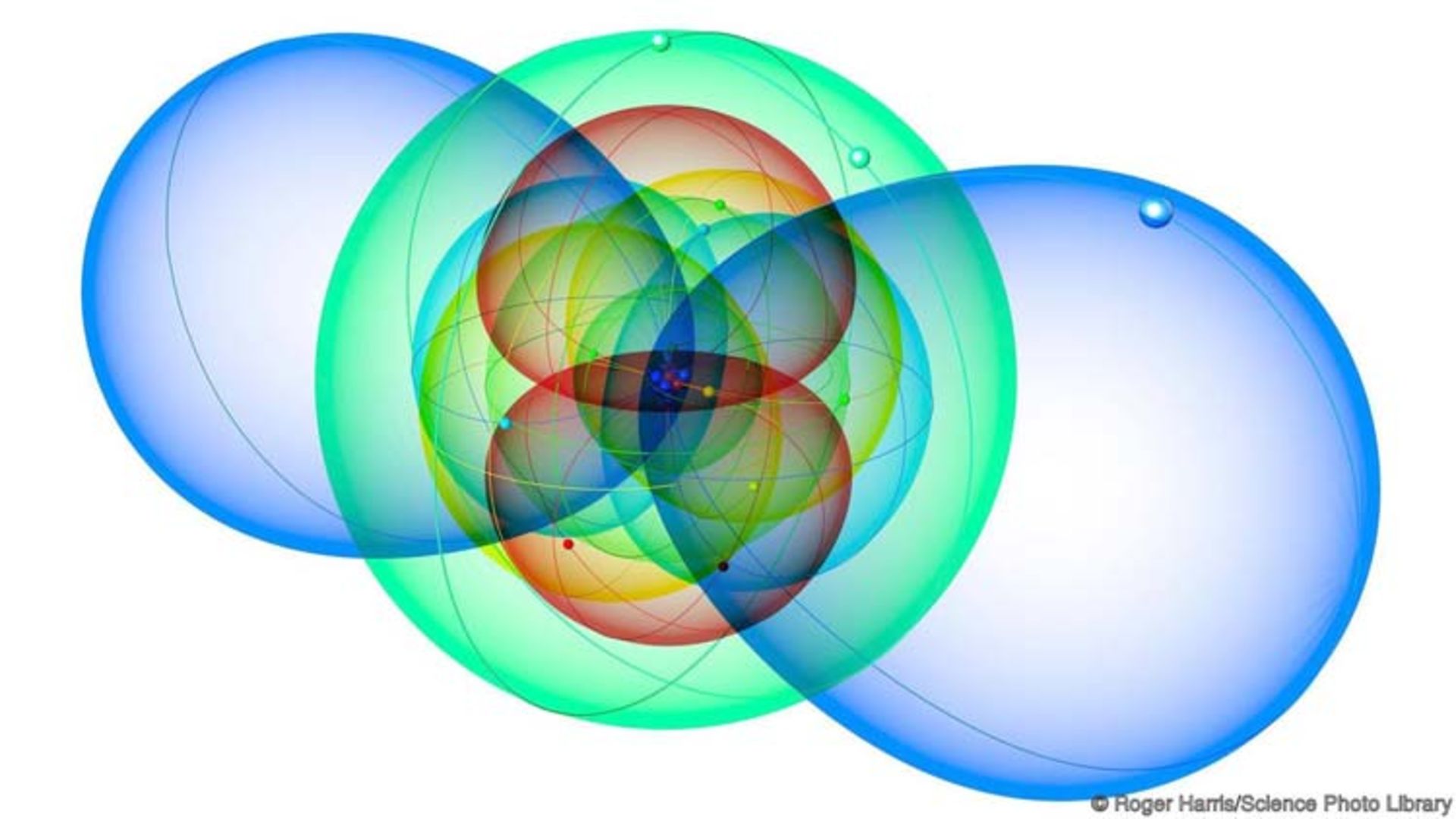
الکترونهای مستقر در اتمها در گروههایی به نام "پوسته" سازمان یافتهاند. هر پوسته ظرفیت متفاوتی دارد و پوسته است که شکل و رفتار اتم در جدول تناوبی را تعیین میکند.
اولین پوسته، تنها دو الکترون را در خود جای میدهد. عنصر هیدروژن دارای یک الکترون و هلیم دارای دو الکترون است. پوستهی دوم پذیرای ۸ الکترون است. به همین دلیل ردیف دوم جدول تناوبی داری ۸ عنصر است. به دنبال آن پوستههای بعدی الکترونهای بیشتری را در خود جای میدهند.
۴ عنصر جدید، آخرین اعضای باقی مانده از ردیف هفتم هستند. چنانچه عنصر ۱۱۹ کشف شود، اولین عضو ردیف هشتم به شمار خواهد آمد. ضمن این که اولین عنصری است که الکترون آن وارد پوستهی هشتم شده است.

عنصرهای هر ستون جدول، خواص شبیه به یکدیگر دارند. چرا که خارجیترین پوستهی هر کدام تعداد الکترون برابر دارد.
به عنوان مثال، تمام عنصرهای موجود در ستون اول سمت چپ جدول تناوب، فلزات واکنش پذیر هستند. همهی آنها یک الکترون در پوستهی بیرونی خود دارند که باعث ناپایداری آنها شده است و تمایل دارند که آن تک الکترون را از دست بدهند.
در مقابل، پوستهی خارجی عنصرهای موجود در ستون راست جدول دارای حداکثر ظرفیت الکترون هستند. از این رو هیچ تمایلی به واکنش ندارند و از آنها به عنوان"گازهای بیاثر" یاد میشود.
با این حال این قوانین شناخته شده در مورد عنصرهای فوق سنگین چندان صدق نمیکند.
رد پای نسبیت خاص
الکترونهایی که نزدیک به هسته هستند به علت نیروی جاذبه بین بارهای مثبت و منفی، پیوند محکمی با آن دارند لذا دامنهی حرکت آنها محدود است. این الکترونها سرعت بسیار بالایی دارند و در اینجا فرضیهی نسبیت خاص انیشتین خود را نشان میدهد که در سرعتهای نزدیک به سرعت نور جرم هم افزایش پیدا میکند.

از این رو الکترونهای داخلی سنگینتر هستند. بنابراین الکترونهای لایهی بیرونی هستند که خواص و ویژگیهای هر عنصر را تعیین میکنند. چرا که جنبش و حرکت آنها فقط به لطف بار الکتریکی شان صورت میگیرد.
آخرین نتیجهای که میتوان از "نسبیت گرایی" استنباط کرد این است که یک عنصر فوق سنگین آن طور که انتظار میرود، رفتار نمیکند. با این حال بررسی چنین رفتارهای دور از انتظاری، عملیات طاقتفرسایی محسوب میشود. چرا که باید رفتار شیمیایی و چند ثانیهای تعداد محدودی اتم خاص را مورد مطالعه قرار داد.
از طرفی عنصرهای فوق سنگین هرچه سنگینتر میشوند تمایل بیشتری به واپاشی هرچه سریعتر دارند. بنابراین مشکلات این بررسی تنها محدود به بحث شیمی نمیشود.
با این همه، امکان بررسی نحوهی پایدار ساختن هستههای بزرگتر وجود دارد و مدت پایداری آنها در حدی است که بتوان این موضوع را دربارهی آنها مورد مطالعه قرار داد. از این رو هیچ دلیلی وجود ندارد که به ردیف هشتم جدول تناوبی جهش نکنیم.
پایداری اتمهای فوق سنگین

در واقع، عنصرهای فوق سنگین همیشه در کمترین سطح پایداری نیستند و پایداری آنها به تعداد پروتونها و نوترونهای موجود در آنها بستگی دارد.
فیزیکدانان هستهای راهکاری پیدا کردهاند که پروتونها و نوترونهای موجود در هسته را همانند الکترونهای چرخان، به وسیله پوسته سازماندهی کنند. با نسبت دادن "اعداد جادویی" به هر پوسته میتوان هستهای با ثبات ایجاد کرد.
هستههای عنصرهایی چون هلیم، اکسیژن، کلسیم، قلع و سرب دارای پوستهای پر شده از پروتون است و همین موضوع منجر به ثبات ساختار آنها شده است. پوستههای پر شده از نوترون هم ممکن است نقشی در این ثبات ایفا کنند. برای مثال پوستههای ایزوتوپ سرب ۲۰۸ با هر دو نوع ذرات پروتون و نوترون پر شدهاند.
برای هستهی عنصرهای فوق سنگین پیدا کردن اعداد جادویی کار سختتری است از این رو پایدارسازی آنها سختتر صورت میگیرد.

زمانی تصور میشد که دو ایزوتوپ عنصر ۱۱۴ که به افتخار "گئورکی فلرو" (دانشمند هستهای روسی) فلروویوم نام گرفته است به علت پر شدن لایههای مربوط به اعداد جادویی پایدار هستند. این ایزوتوپها به ترتیب ۱۸۴ و ۱۹۶ نوترون داشتند و به عنوان فلروویوم ۲۹۸ و فلروویوم ۳۱۰ شناخته شده بودند.
هر چند که این احتمال وجود دارد که ثبات فلروویوم را بتوان به اثرات پوسته- هسته نسبت داد. نیمه عمر فلروویوم ۲۹۸ حدود ۱۷ روز برآورد شده است که در مقایسه با نیمه عمر استاندار عنصرهای فوق سنگین عدد بزرگی محسوب میشود. تاکنون، طولانیترین نیمه عمر به ایزوتوپ فلروویوم ۲۸۹ تعلق داشت که تنها ۲.۶ ثانیه بود. با این حال به نظر میرسد که جزیرهی ثبات تا زمان کشف عنصر ۱۲۲ تحقق پیدا کند.
هنوز مشخص نیست که آیا عنصرهای فوق سنگین میتوانند به اندازهی کافی بقا داشته باشند تا بتوانند تشکیل تودههای قابل ملاحظه بدهند یا خیر. هر چند که بعید به نظر میرسد. تنها کورسوی امیدی که وجود دارد این است که تعداد کمی اتم این امکان را دارند که برای چند روز در اطراف یکدیگر چسبندگی برقرار کنند.
ساخت عنصرها تا کجا؟

سوالی که ممکن است مطرح شود این است که چه زمانی اتمهای یک عنصر آن قدر سنگین میشوند که دیگر احتمال برقراری عنصر از بین میرود؟
"ریچارد فاینمن" فیزیکدان آمریکایی در خصوص این نکته بررسیهایی انجام داده است. وی با انجام یک محاسبهی کلی و سریع نشان میدهد که نمیتوان اتمی با ۱۳۷ پروتون در هسته ساخت و در چنین شرایطی اتم دچار واپاشی خواهد شد. چرا که تعادل چرخشی الکترونهای نزدیک به هسته را بر هم میزند. به بیانی دیگر، هستهای با ۱۳۷ پروتون نمیتواند الکترونها را در اطراف خود نگه دارد.
با این حال، محاسبهی فاینمن براساس تقریب صورت گرفته است و اندازهی هسته در آن صفر فرض شده که در واقع چنین نیست. وقتی این محاسبات به شکل دقیقتری انجام شد، نشان داد تا زمانی که عدد اتمی به ۱۷۳ برسد هیچ پیامد نامطلوبی مشاهده نخواهد شد. البته بالاتر از این عدد هم اتم پایدار باقی میماند اما رفتارهای غیر منتظرهای از خود نشان خواهد داد.
توجیه با کمک کوانتوم

مانند دیگر مقیاسهای کوچک، این مورد را هم باید رهسپار مکانیک کوانتومی کرد! مکانیک کوانتومی امکان جفت شدن خواص مکانیکی دو ذرهی کاملا مجزا را در نظر میگیرد که میتوانند از هیچ به وجود بیایند و یکی ضد دیگری باشد. برای مثال یک ذره، الکترون است که به دنبال آن یک پوزیترون تولید میشود. بهطور معمول، پس از برخورد دو ذره، هر دو نابود خواهند شد.
از این رو نامتعادل و غیرمعمول بودن الکترونهای داخلی عنصری با عدد اتمی ۱۷۳ ممکن است در اثر بیرون کشیده شدن به وسیلهی ذرات مجازی باشد. چنانچه یکی از این الکترونها توسط پراش اشعهی ایکس، از پوستهی خود جدا شود یک حفرهی خالی بر جای میگذارد. این حفره میتواند توسط ذرهی الکترونی ایجاد شده از هیچ، پر شود. ضمن این که برای شکلگیری این الکترون، یک پوزیترون هم باید تشکیل شود که توسط اتم شکل خواهد گرفت. به عبارت دیگر، ابر الکترونی این عنصرهای واقعا بزرگ، به ذرات ضد ماده تبدیل شود.
بنابراین اگر هیچ پایانی برای جدول تناوبی وجود نداشته باشد، باید چشم انتظار موارد عجیب و غریبی باشیم. ضمن این که ساخت عنصرهای باقی مانده خود داستان دیگری است.

آیفونی را تصور کنید که از هر زاویه شفاف باشد و بتوان از همهی سطوح آن استفاده کرد.

دانشمندان بیش از ۸۰ سال است که در حال ساخت سلاحهای هستهای هستند، اما ساخت آنها همچنان چالشبرانگیز است.

وال کیلمر، بازیگر مشهور هالیوود، در سن ۶۵ سالگی از دنیا رفت.

اگر تاریخ به شکل دیگری رقم خورده بود، شاید حرکت پادساعتگرد به جای حرکت ساعتگرد به یک قاعده تبدیل میشد.

در آستانهی پنجاهمین سالگرد مایکروسافت، اظهارات قدیمی بیل گیتس دربارهی یکی از تصمیمهای مهم دوران مدیریتش دوباره در کانون توجه قرار گرفته است.

اولین گوشی از سری Edge 60 موتورولا معرفی شد؛ موبایلی با انبوهی از قابلیتهای هوش مصنوعی.

سامسونگ با Awesome Intelligence قابلیتهای هوش مصنوعی جدیدی برای بهبود تصاویر و جستوجوی بهتر و تبدیل متن آنلاین به صدا ارائه میدهد.




