فناوریهای جدید، نویدبخش دید مصنوعی واضحتر برای افراد نابینا

قانونگذاران آمریکایی در سال ۲۰۱۴ درمانی آیندهنگرانه را برای بینایی تصویب کردند. دستگاه آنها که آرگوس ۲ (Argus II) نامیده میشد، سیگنالهایی را از دوربینی که روی یک عینک قرار داده شده بود، به شبکهی ۵*۳ میلیمتری از الکترودها که پشت چشم قرار داشت، ارسال میکرد. وظیفهی دستگاه مذکور جایگزینی سیگنالهای حاصل از سلولهای حسکنندهی نور بود که در بیماری ژنتیکی رتینیت پیگمانتر از بین میروند. سازندهی این ایمپلنت یعنی شرکت دید دوم (Second Sight) برآورد کرده است که در حال حاضر، ۳۵۰ نفر در جهان در حال استفاده از این ایمپلنت هستند. آرگوس ۲ شکل نسبتا خامی از دید مصنوعی ارائه میدهد؛ کاربران لکههای پخششده از نوری را که فسفن نامیده میشود، میبینند. دانیل پالانکر، فیزیکدانی که در دانشگاه استنفورد روی پروتزهای بینایی کار میکند، میگوید:
هیچکدام از بیماران عصای سفید یا سگ راهنمای خود را رها نکردند. این دستگاه کیفیت پایینی دارد.
اما این آغاز کار بود. اکنون، پالانکر و پژوهشگران دیگر قصد دارند با روشهای دقیقترِ تحریک سلولهای چشم یا مغز این سیستم را ارتقا دهند. دانشمندان در نشست سالانهی انجمن علوم اعصاب که هفتهی گذشته برگزار شد، پیشرفتهای حاصل از چندین تلاش مرتبط با این مساله را با هم به اشتراک گذاشتند. پالانکر میگوید:
برخی از این فناوریها وارد آزمایشهای انسانی شده است؛ یک آزمایش واقعی و نهایی. این زمان هیجانانگیزی است.
چندین اختلال شایع با تخریب گیرندههای نور در چشم موجب نابینایی میشوند. گیرندههای نور نخستین سلولها در فرایند انتقال اطلاعات از چشم به مغز هستند. سایر عوامل موثر در این انتقال اغلب دستنخورده باقی میمانند: سلولهای دوقطبی که سیگنالهای حاصل از گیرندههای نور را دریافت میکنند، سلولهای گانگلیونی شبکیه که عصب بینایی که تشکیل میدهند و سیگنالها را به مغز انتقال میدهند؛ و قشر بینایی چندلایه که در پشت مغز قرار گرفته است و اطلاعات را به شکل دیدی معنادار سازماندهی میکند.
از آنجایی که سیگنال حاصل از نقاط مجاور در فضا، وارد نقاط مجاوری در شبکیه میشود و درنهایت نقاط همسایه را در منطقه پردازشکنندهی اولیه از قشر بینایی فعال میکند، یک صحنهی بینایی میتواند براساس الگوی فضایی سیگنالها نقشهیابی شود. اما این نقشهبرداری فضایی در مسیر انتقال پیچیدهتر میشود، بنابراین برخی از پژوهشگران میخواهند تا جایی که ممکن است سلولها را در نقطهی آغاز فعال کنند.
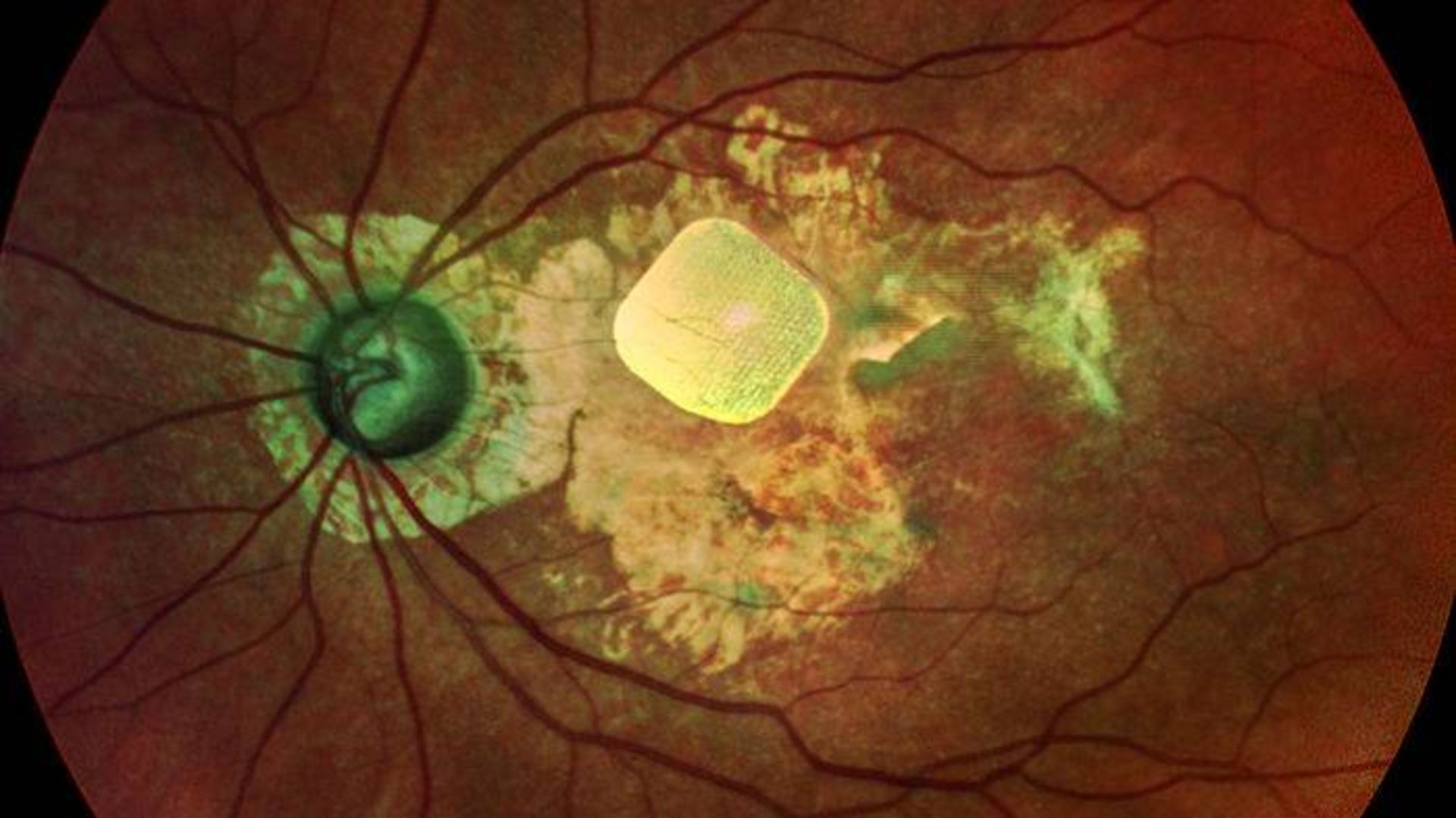
شبکهای از فوتودیودها که در چشم فرد مبتلا به دژنراسیون ماکولا کاشته میشود، یکی از چندین دستگاه در حال توسعه برای بازیابی بینایی است
تیم پالانکر یک ایمپلنت شبکیهای حاوی حدود ۴۰۰ فوتودیود یا پیکسل را طراحی کرده است که جایگزین بخشی از نقشهی فضایی شبکیه میشود. یک جریان ویدئویی از جهان خارج بهشکل نور مادون قرمز نزدیک درون عینک نشان داده میشود و پیکسلهای ایمپلنت آن را برای تحریک سلولهای دوقطبی شبکیه به سیگنال الکتریکی تبدیل میکنند.
شرکت پیکسیوم ویژن (Pixium Vision) که در پاریس قرار دارد، درحال آزمایش این دستگاه روی پنج فردی است که دچار بیماری تخریبکنندهی سلولهای گیرنده نور یعنی دژنراسیون ماکولا (تباهی لکه زرد) هستند. در نشست هفتهی گذشته، پالانکر ویدئوهایی را ارائه داد که نشان میداد شرکتکنندگانی که حدود یک سال است دارای این ایمپلنت هستند، میتوانند اشیاء موجود روی یک میز تشخیص دهند و حروف چاپی یا حروف روی صفحهی نمایش را بخوانند. پالانکر میگوید، دید مصنوعی تا اندازهای خوب است که فرد فقط میتواند عنوان کتاب را بخواند و نه کلمات موجود در صفحهی کتاب را. گروه پالانکر در حال تلاش برای کوچکتر کردن فتودیودها هستند: ایجاد پیکسلهای ریزتر و دید واضحتر بدون کاهش زیادی در شدت سیگنال.
پژوهشگران دیگر برای رسیدن به دقت بالاتر نسبتبه روش تحریک الکتریکی، به اپتوژنتیک روی آوردهاند. اپتوژنتیک تکنیکی است که برای فعال کردن سلولها از نور استفاده میکند. در آزمایشی بالینی که بهوسیلهی شرکت ژنسایت بیولوژیکس (GenSight Biologics) انجام شد، پژوهشگران ویروس بیضرری را که حامل ژن کدکنندهی پروتئین حساس به نور بود، به چشم ۵ نفر مبتلا به رتینیت پیگمانتر وارد کردند. سلولهای گانگلیونی شبکیه که این ژن را برمیدارند، میتوانند به نور قرمزی که وارد چشم میشود، پاسخ دهند. خوزه آلین ساهل، دانشمند علوم اعصاب و چشم پزشکی که درحال آزمایش این فناوری در دانشکدهی پزشکی پیتسبرگ است، میگوید اینکه وضعیت بینایی این شرکتکنندگان آزمایش رضایتبخش خواهد بود یا نه، باید در سال آینده مشخص شود.
اما درمانهایی که سلولهای شبکیه را مورد هدف قرار میدهند، به افرادی که بهخاطر جراحت یا آسیب شدید به عصب بینایی چشم در اثر بیماریهای مانند گلوکوم قادر به دیدن نیستند، کمک نمیکنند. شرکت دید دوم قصد دارد که این بیماران را با استفاده از ایمپلنت اوریون (Orion) درمان کند؛ ایمپلنتی متشکل از ۶۰ الکترود که مستقیما روی قشر بینایی قرار میگیرد و با استفاده از یک دوربین ویدئویی نصبشده روی یک عینک، سیگنالهای مغزی را تغذیه میکند. چهار نفر از پنج بیمار نابینایی که حدود یک سال است از این ایمپلنت استفاده میکنند، بهتر میتوانستند مربع سفیدی را که به اندازهی یک مشت بود، روی صفحهی سیاهی مکانیابی کنند. هر پنج نفر بهتر میتوانستند جهتی را که در آن یک نوار سفید روی صفحهی نمایش در حال حرکت بود، تشخیص دهند. جسی دورن، مدیر پژوهشهای علمی شرکت میگوید: «ما دلگرم شدیم.»
الکترودهایی که روی سطح مغز قرار داده میشوند، اشکالاتی دارند. از آنجایی که برای فعالکردن نورونهای هدف که در بافت زیرین قرار دارند، از جریان بسیار قوی استفاده میشود، فعالشدن چندین الکترود بهطور همزمان خطر بروز تشنج را با خود بههمراه دارد. از طرف دیگر، فعالشدن الکترودهای مجاور میتواند موجب تحریک بافت بین آنها شود و دو نقطهی بینایی گسسته را درون یک نقطه با هم ترکیب کند. البته در نشست مذکور، همکاران شرکت دید دوم در کالج پزشکی بیلور شواهدی را ارائه دادند که ۶۰ الکترود میتوانند فسفنهایی را در بیش از ۶۰ نقطه ایجاد کنند.
دانشمندان از تکنیکی بهنام هدایت جریان استفاده کردند که قبلا برای تقویت درک زیروبمی صدا در ایمپلنت حلزون گوش مورد استفاده قرار گرفته بود. الکترودهایی که عمیقتر در قشر بینایی نقوذ میکنند، میتوانند به نورونهای هدف نزدیکتر شوند و از جریان کمتری برای فعالکردن نقاط کوچکتر و دقیقتری در بافت استفاده کنند.
هفتهی گذشته، زینگ چن، دانشمند علوم اعصاب آزمایشگاه پیتر رولفسما در موسسهی علوم اعصاب هلند آزمایشهای انجامشده روی ایمپلنتهای حاوی هزار الکترود واردشونده به مغز را در دو میمون بینا شده ارائه داد. با فعالشدن همزمان ۱۰ تا ۱۵ عدد از الکترودها، حیوانات میتوانستند بین حروف مختلفی که پژوهشگران در میدان بینایی آنها میتاباندند، تمایز قائل شوند. رولفسما امیدوار است که آزمایشهای انسانی خود را تا سال ۲۰۲۳ آغاز کند.
استفان مکنیک، دانشمند علوم اعصاب دانشگاه علوم پزشکی داون استیت در نیویورک هشدار میدهد که مغز درنهایت جای زخمی را در اطراف سیمهای کاشتهشده ایجاد میکند و آنها را از نورونهای هدف دور میکند. او میگوید:
چنین ایمپلنتهایی قشر را برای تمام ایمپلنتهای آینده خراب میکنند و در بهترین حالت، کاربر دیگر چیز زیادی نخواهد دید.
مکنیک ادعا میکند که اپتوژنتیک دید واضحتری فراهم میکند و ساخت الکترودهایی که باید وارد مغز شوند، غیراخلاقی است. در نشست انجمن علوم اعصاب، او برنامههایی را درمورد فناوری به نام OBServ ارائه کرد که ژن اپسین حساس به نوری را به نورونهایی که از یک ایستگاه سیگنالدهنده در پایهی مغز به قشر بینایی میرسند، اضافه میکند. او توضیح داد که آن سلولها میتوانند با نوری که از سطح مغز تابیده میشود، فعال شوند.
سیستمهای اپتوژنتیکی قشری مانند سیستم OBServ به این زودی به کلینیکها نمیرسند. پژوهشگران ابتدا باید ثابت کنند که ویروس میتواند بهطور ایمن و قابل اطمینان ژن اپسین را به نورونهای خاصی برساند. آنها همچنین باید یک دستگاه بسیار دقیق و در عین حال فشرده را زیر جمجمه قرار دهند که در زمان خواندن فعالیت عصبی، نوری را بر مغز بتاباند تا تحریک را حین انتقال تنظیم کند.
بسیاری از پژوهشگران معتقدند، یکی از بزرگترین موانع تاباندن بینایی بسیار دقیق به مغز مسالهی اساسیتری است: کشف اینکه مغز کدام الگوهای تحریک را میتواند تفسیر کند. ویلیام بوسکینگ، دانشمند علوم اعصاب بیلور میگوید:
ما فکر نمیکنیم فقط بهخاطر اینکه مثلا یک میلیون الکترود یا فعالسازی فضایی اپتوژنتیک کاملی دارید، همهچیز حل شده باشد. ما باید یاد بگیریم که چگونه با قشر مغز صحبت کنیم.
نظرات